ISOMERÍA
3. Isomería espacial o estereoisomería
3.1. Isomería conformacional
Conformaciones del etano
Construyendo un modelo molecular del etano comprobaremos que los dos grupos metilo pueden rotar fácilmente uno respecto al otro. La energía necesaria para mover los átomos de hidrógeno de un metilo respecto del otro, o barrera de rotación, es de 2.9 kcal/mol. Este valor es tan pequeño que los químicos hablan de libre rotación de los grupos metilo. En general, hay rotación libre alrededor de todos los enlaces simples.
La conformación producida por la rotación respecto al enlace carbono-carbono del etano representa un continuo entre los dos extremos que se muestran arriba: una conformación alternada o escalonada y una conformación eclipsada. Entre estos dos extremos hay una cantidad infinita de conformaciones posibles.
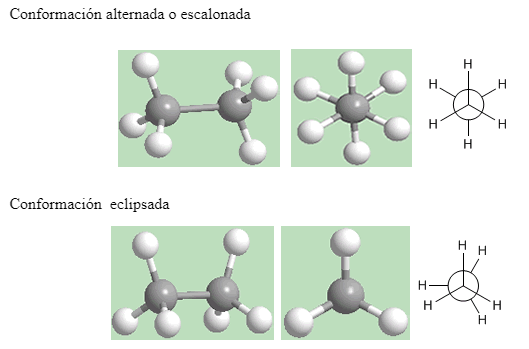
La conformación alternada es más estable, y por consiguiente su energía es menor que la conformación eclipsada. La conformación de una molécula cambia millones de veces por segundo, de alternada a eclipsada, a temperatura ambiente. Debido a esta interconversión continua, no se pueden separar entre si los diferentes confórmeros, aunque algunos tienen más probabilidad de persistir que otros.
Les dejamos un video del profesor Ernesto Brunet Romero
Conformaciones del ciclohexano
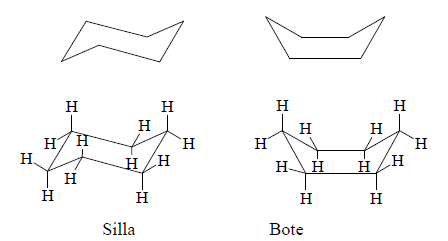
Los compuestos cíclicos más frecuentes en la naturaleza contienen anillos de seis miembros. La conformación más favorecida para el ciclohexano es la conformación de silla, un ordenamiento que casi está libre de tensión, donde todos los ángulos de enlace son de 111°, muy cercanos al ángulo tetraédrico ideal de 109,5° y todos los hidrógenos unidos sobre carbonos adyacentes se encuentran perfectamente escalonados. En la conformación de silla, los hidrógenos del ciclohexano pueden ser de dos clases, que reciben los nombres de axiales y ecuatoriales. El ciclohexano se interconvierte rápidamente entre confórmeros silla estables por la facilidad de rotación respecto a sus enlaces C-C.
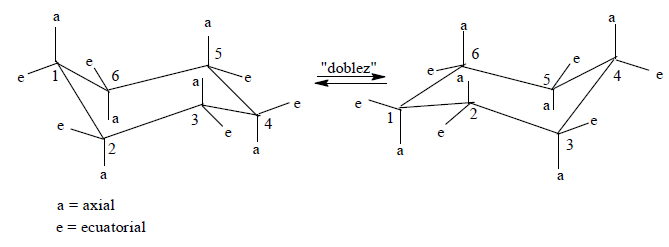
Los enlaces axiales de la estructura de la izquierda, se convierten en enlaces ecuatoriales en la estructura de la derecha, cuando el anillo se "dobla". En este compuesto, también existe una conformación de bote, la cual no resulta tan estable porque algunos de los enlaces se encuentran eclipsados.
Les dejamos un video del profesor Ernesto Brunet Romero