HIDROCARBUROS
3. ALQUENOS
Los alquenos también son hidrocarburos, ya que sólo están formados por átomos de carbono e hidrógeno, pero se diferencian de los alcanos por la presencia de dobles enlaces.Debido a que estos compuestos son capaces de tomar H2 para transformarse en hidrocarburos saturados (alcanos) se los conoce con el nombre general de hidrocarburos insaturados.
En este video se presentan los alquenos hasta cuatro átomos de carbono, su estructura, su nomenclatura y los tipos de isomería que presentan.
En este video se presenta la hibridación de los alquenos y sus propiedades de enlace.
Nomenclatura
http://www.qorganica.es/QOT/T4/nomenclatura_alquenos_exported/index.html
Propiedades físicas
http://www.qorganica.es/QOT/T4/pfis_alquenos_exported/index.html
Reacciones
Preparación de alquenos
1. DESHIDROHALOGENACIÓN DE HALOGENUROS DE ALQUILO


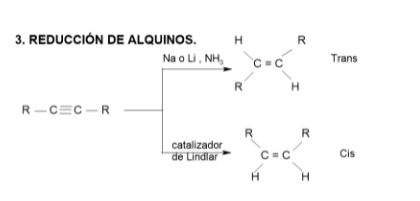
http://www.qorganica.es/QOT/T4/reduccion_alquinos_exported/index.html
REACCIONES DE ADICIÓN
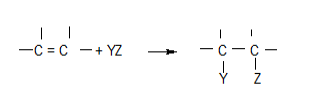
Una reacción de adición es aquella en la cual dos moléculas se unen entre sí (se adicionan) para formar una mayor. Nada se pierde en este proceso, ya que todos los átomos de las moléculas originales están formando parte de la nueva molécula obtenida. Además, para que estas reacciones tengan lugar es necesario que al menos uno de los reactivos posea un doble o un triple enlace.
Las reacciones de adición pueden ser homolíticas (por radicales libres) y heterolíticas (iónicas).
Si las reacciones son heterolítcas suelen clasificarse además en nucleofílicas o electrofílicas según las características del reactivo atacante.
Acá estudiaremos la adición por radicales libres en alquenos. En el caso de los alquinos el mecanismo es igual pero, en lugar de la adición de una molécula, se pueden adicionar dos.
Recordemos que los alquenos poseen un doble enlace que consiste en una unión σ fuerte y una π débil, por lo que es de esperar que los radicales libres puedan utilizar electrones de la nube π.
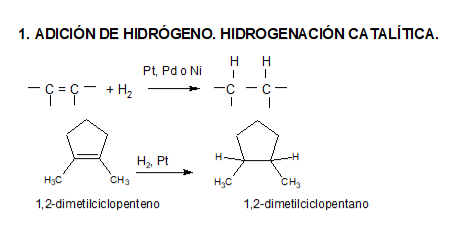
La hidrogenación puede realizarse por dos métodos distintos (reacción heterogénea y reacción homogénea). En ambos casos, el catalizador provoca la adición de hidrógeno molecular al doble enlace.
Hidrogenación heterogénea (dos fases)
Es el método clásico, todavía muy utilizado. El catalizador es un metal finamente dividido, por lo común platino, paladio o níquel.
Se agita una solución del alqueno bajo una ligera presión de hidrógeno en presencia de una pequeña cantidad del catalizador. La reacción es rápida y suave y, una vez completada, se separa mediante filtración el producto saturado del catalizador.
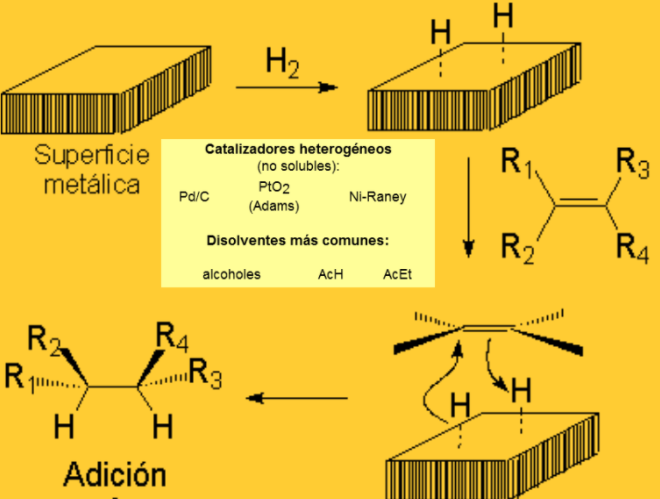

Hidrogenación homogénea (una fase)
Este método es mucho más moderno y ofrece una flexibilidad imposible de alcanzar con los catalizadores antiguos. Mediante modificaciones en los catalizadores, puede llevarse a cabo la hidrogenación con una gran selectividad.
Los catalizadores son complejos orgánicos de metales de transición, como rodio o iridio (ej.: catalizador de Wilkinson). Los mismos son solubles en disolventes orgánicos y la hidrogenación se efectúa así en una sola fase. El inconveniente del método es la dificultad de separación del catalizador y el producto una vez terminada la reacción. Sin embargo, se están realizando estudios para resolver esta dificultad: el catalizador va incorporado químicamente a un polímero sólido insoluble, lo que permite una filtración fácil al final de la reacción. De esta manera, la hidrogenación homogénea se convierte en heterogénea, pero el modo de acción parece permanecer igual.
Calor de hidrogenación
La hidrogenación es exotérmica, porque los dos enlaces σ (C-H) que se forman liberan más energía que la que se absorbe al romperse los enlaces σ (H-H) y π. La cantidad de calor desprendida al hidrogenar un mol de un compuesto se llama calor de hidrogenación; es simplemente el ΔH de la reacción.
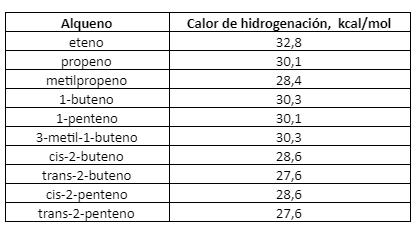
El Calor de Hidrogenación de casi todo alqueno se aproxima bastante a un valor de 30 kcal por cada doble enlace del compuesto, lo que puede observarse en la tabla siguiente:
Calor de hidrogenación y estabilidad de los alquenos
A menudo, los calores de hidrogenación pueden brindarnos información valiosa acerca de las estabilidades relativas de compuestos no saturados.
En los 2-butenos isómeros, por ejemplo, el cis tiene un calor de hidrogenación de 28.6 kcal, y el trans, de 27.6 kcal. Ambas reacciones consumen un mol de hidrógeno y dan el mismo producto, n-butano. Por lo tanto, si el isómero trans libera 1 kcal menos de energía que el cis, sólo puede significar que contiene 1 kcal menos de energía. En otras palabras, el isómero trans es más estable que el cis en 1 kcal.
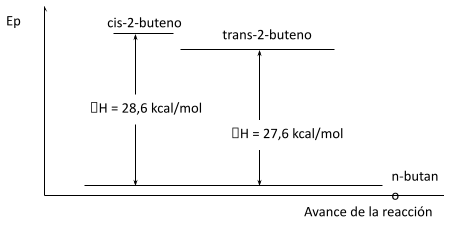
De los alquenos simples disustituidos, el isómero trans generalmente es el más estable; los dos sustituyentes mayores están más separados que en el isómero cis, por lo que hay menos impedimento y menor tensión de Van der Waals.
Los calores de hidrogenación indican que la estabilidad de un alqueno también depende de la ubicación del doble enlace. Son característicos los ejemplos siguientes:
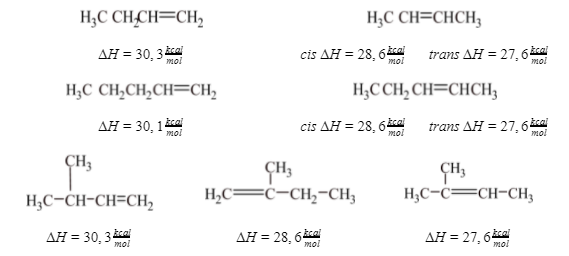
Cada grupo de alquenos isómeros da el mismo alcano. En consecuencia, las diferencias en calores de hidrogenación deben proceder de diferencias en estabilidades. En cada caso, se observa que cuanto mayor es el número de grupos alquilo unidos a los carbonos del doble enlace, menor es el calor de hidrogenación y más estable es el alqueno.

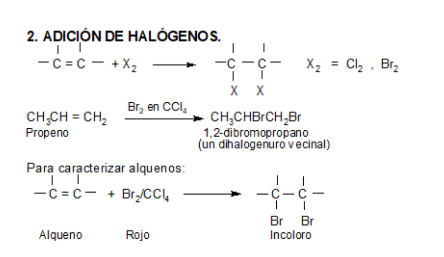
A diferencia de los alcanos, los alquenos reaccionan rápidamente a temperatura ambiente y en ausencia de luz con bromo líquido puro o con una solución de bromo en algún solvente orgánico como el tetracloruro de carbono. El doble enlace se rompe y los átomos de bromo se adicionan a cada uno de los carbonos. El color rojo amarronado característico del bromo se pierde, obteniéndose un líquido incoloro. Por ello, esta es una reacción útil para distinguir alcanos de alquenos. Los productos de estas reacciones son dihaluros vecinales.
Los otros halógenos, excepto el flúor, se comportan en forma similar. (El flúor reacciona con todos los hidrocarburos en forma explosiva dando carbón y fluoruro de hidrógeno)
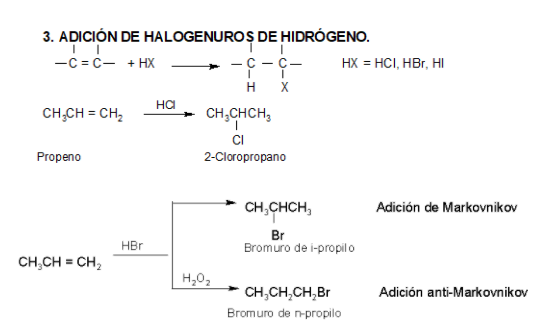
Los ácidos fuertes de Brönsted, tales como HCl, HBr y HI se adicionan rápidamente al doble enlace.
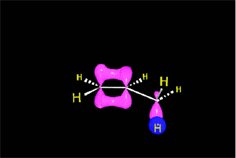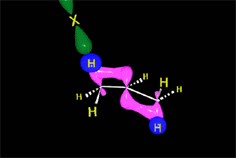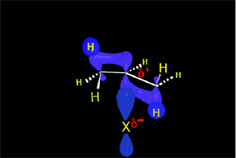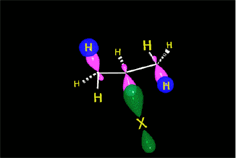
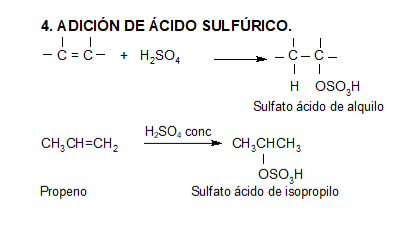
https://aulaabierta.ingenieria.uncuyo.edu.ar/mod/resource/view.php?id=61727
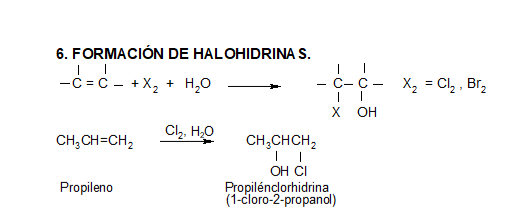
En el caso del ácido hipobromoso o hipocloroso (XOH), que son ácidos débiles de Brönsted, no reaccionan como dadores de protones. Ya que el oxígeno es más electronegativo que el cloro o el bromo, el electrófilo será el catión del halógeno (X+). La especie nucleofílica que se une al carbocatión intermedio es por lo tanto el ion hidróxido. El producto es denominado halohidrina.
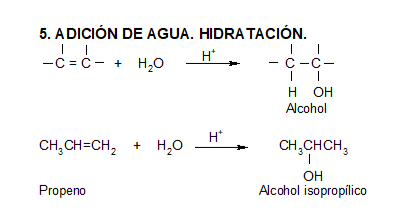
Los ácidos débiles como el agua normalmente no se adicionan a los alquenos. Sin embargo, una pequeña cantidad de ácido fuerte (ej.: SO4H2) sirve para catalizar la adición de agua, obteniéndose de esta manera alcoholes a partir de alquenos.
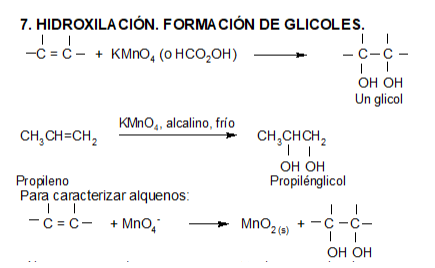
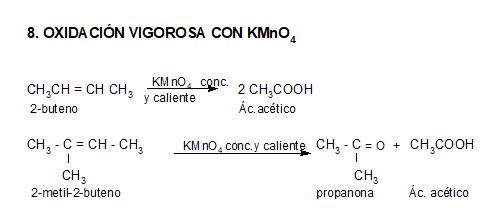
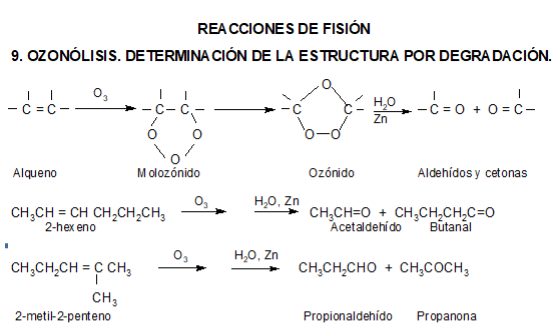
Reacciones de oxidación