HIDROCARBUROS
4. ALQUINOS
Los alquinos presentan una triple ligadura como grupo funcional. También se los conoce como hidrocarburos acetilénicos, si bien acetileno es el nombre común del menor de los miembros de esta familia.
Nomenclatura
http://www.qorganica.es/QOT/T5/nomenclatura_alquinos_exported/index.htmlPropiedades físicas
El triple enlace de los alquinos está constituído por el solapamiento frontal de dos híbridos sp (un enlace "sigma") y el solapamiento lateral de cuatro orbitales p sin hibridar (dos enlaces "pi"):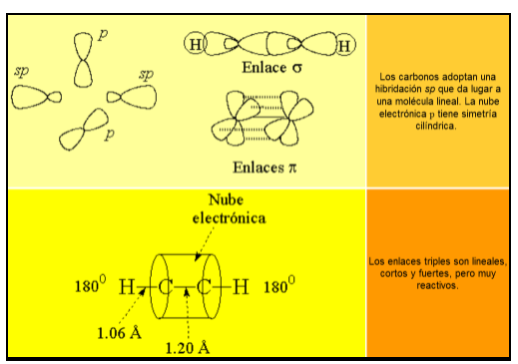
Los alquinos tienen propiedades físicas parecidas a los alcanos y alquenos correspondientes.

MUY IMPORTANTE: El acetileno y los alquinos terminales son relativamente ácidos:
La carga negativa reside en un orbital sp en el anión del acetileno. Cuanto mayor carácter s tiene un orbital híbrido, los electrones allí alojados estarán más cerca y más atraídos por el núcleo, serán más estables, menos básicos y el ácido conjugado será, por ello, más fuerte.
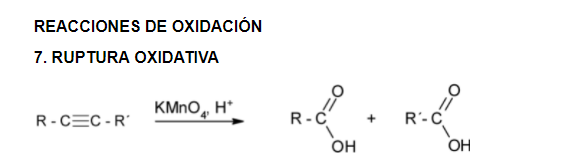
REACCIONES
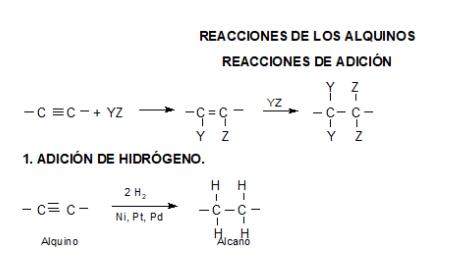
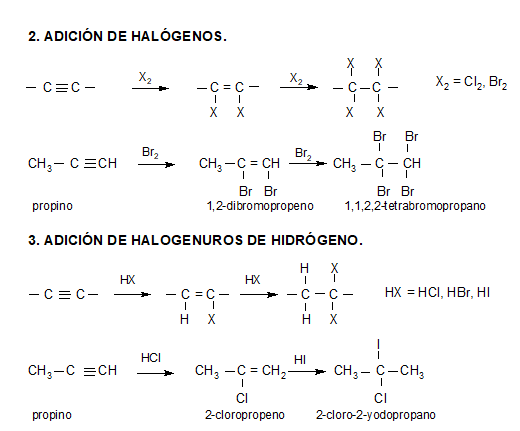
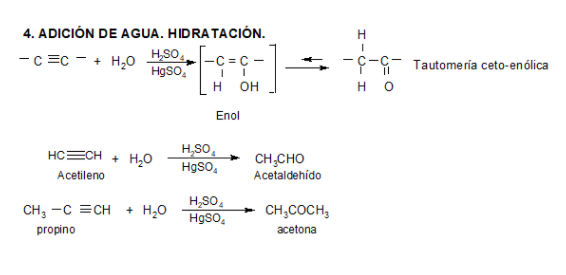
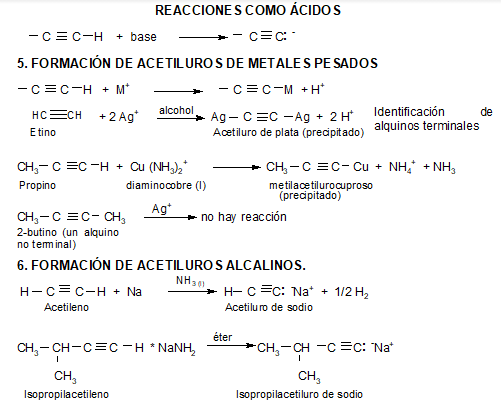
La acidez del acetileno y de los alquinos con el triple enlace en el extremo de la cadena (R-C≡CH) es una propiedad única que diferencia estos hidrocarburos de los alcanos y alquenos. Un carbono con triple enlace es más electronegativo que el carbono con enlace simple o doble. Por lo tanto, un hidrógeno unido a un carbono con triple enlace, como en el acetileno o en otro alquino con triple enlace en el extremo de la cadena, tiene una acidez considerable.
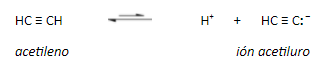
La teoría del enlace de valencia explica este fenómeno basándose en la influencia que tiene la hibridación del átomo de carbono unido a un hidrógeno sobre la acidez: con más carácter s en el orbital híbrido (sp > sp2 > sp3), más cerca del núcleo están los electrones compartidos con el átomo de hidrógeno. Esto hace que, por un lado, aumente la electronegatividad del C, y por ende la polaridad del enlace C-H dejando más expuesto el H. Por otro lado, el anión que se forma al romper el enlace C-H es más estable cuanto más carácter s tiene el orbital híbrido del carbono, porque puede acomodar mejor la carga. Además, el anión formado es una base más débil porque los electrones están menos disponibles al aumentar el carácter s, es decir que su ácido conjugado es más fuerte.