Compuestos oxigenados
2. Fenoles
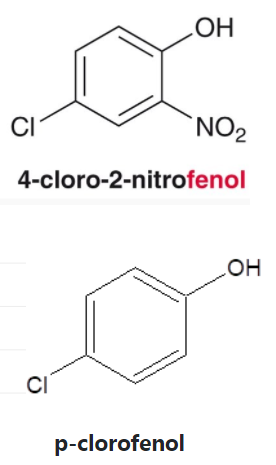
NOMENCLATURA
Los fenoles constan de un grupo hidroxilo unido directamente al anillo bencénico.
Los fenoles sustituidos son muy abundantes en la naturaleza.
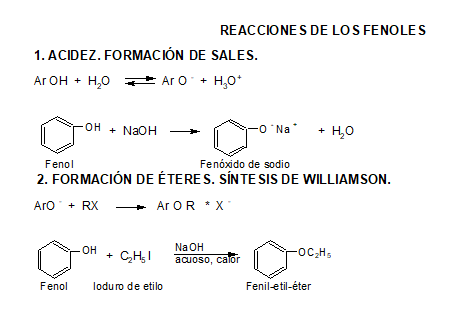
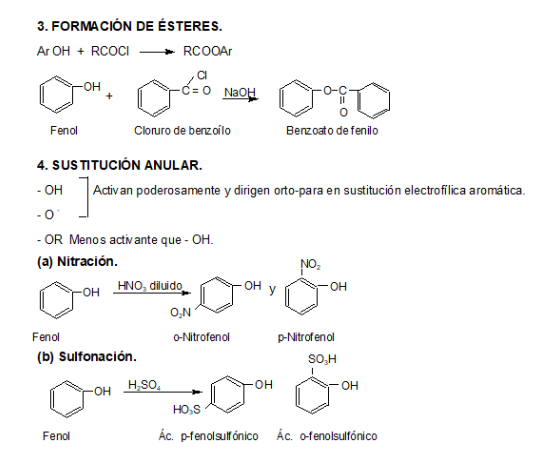
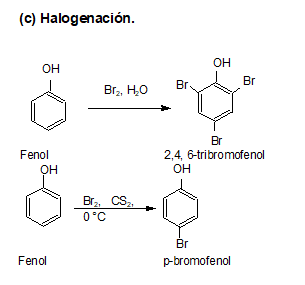
Los fenoles son compuestos ácidos, siendo más ácidos que los alcoholes y el agua.

Observando las estructuras del alcohol, del fenol y de los respectivos aniones, se deduce:
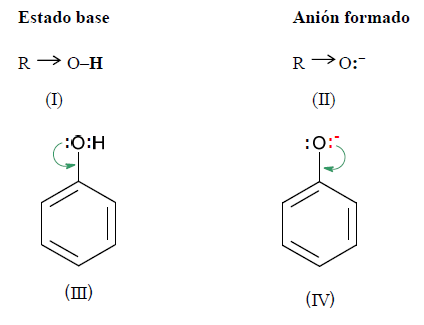
En (I) el efecto inductivo de R aumenta la densidad electrónica sobre el oxígeno, lo que hace que se fortalezca el enlace O - H y, por lo tanto se dificulte su ruptura.
En el ión alcóxido (II), el efecto inductivo de R inestabiliza al anión. Si es menos estable es más difícil de formar
En (III) el efecto mesómero provoca un déficit de densidad electrónica en el oxígeno, lo que significa una mayor atracción por parte del oxígeno de los electrones que comparte con el hidrógeno. Esto facilita la ruptura de dicho enlace.
En el ión fenóxido (IV), hay una gran estabilización por resonancia, es decir, la carga negativa está dispersa en el anión, lo que favorece su estabilización.
A continuación se muestran estructuras contribuyentes del fenol y el anión correspondiente: estructuras V a VII para fenol y VIII al X para el anión.
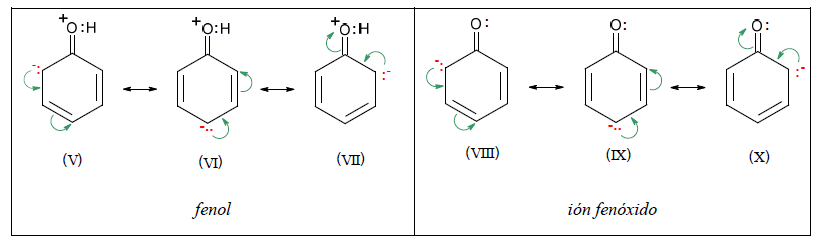
Las estructuras V a VII del fenol son portadoras de una carga positiva y otra negativa, mientras que VIII a X del ión fenóxido sólo llevan una negativa.
Como debe aportarse energía para separar cargas opuestas, las estructuras del fenol deben ser más energéticas y por lo tanto menos estables que las del ión fenóxido. Por otro lado el ión fenóxido, tiene la carga negativa dispersa, como consecuencia del efecto mesómero.
Por lo tanto, el efecto neto de la Resonancia es una estabilización mayor del ión fenóxido que del fenol, por lo que el equilibrio se desplaza en el sentido de la ionización, resultando así Ka mayor que para el alcohol.