4. Estructura de los compuestos orgánicos
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curso: | Química Orgánica 2023 |
| Libro: | 4. Estructura de los compuestos orgánicos |
| Imprimido por: | Cuenta visitante |
| Día: | domingo, 1 de febrero de 2026, 17:26 |
1. Introducción
La mayoría de las veces, para comprender el comportamiento de un compuesto orgánico no basta con conocer la composición del mismo, expresada a través de la fórmula molecular, sino que es necesario saber cómo están unidos los átomos en la molécula, es decir, cómo es la estructura. También la forma o configuración de la molécula es una herramienta útil cuando se estudian las propiedades de los compuestos orgánicos.
Compuesto: Metano | Fórmula Molecular: | CH4 |
Fórmula Estructural: |
| |
Configuración: Tetraédrica regular |
2. Teoría estructural clásica
La fórmula estructural y la configuración no son representaciones sin sentido, sino que si se las analiza sobre la base de la Teoría Estructural se puede arribar a información acerca de las propiedades físicas y químicas de los compuestos. Dicha Teoría explica cuál es el orden de unión de los átomos en las moléculas y qué electrones los mantienen unidos.
En toda fórmula estructural hay enlaces químicos entre los átomos, que son las fuerzas que los mantienen unidos. La Teoría Estructural Clásica (antes de 1926) menciona dos tipos de enlaces:
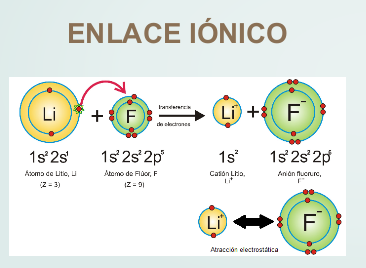
Enlace iónico, donde hay transferencia de electrones
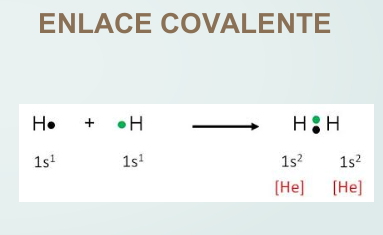
Enlace covalente, donde se comparten los electrones.
Tanto en el enlace iónico como en el covalente, cada átomo tiende a tomar la configuración electrónica del gas noble más próximo. A continuación se dan dos ejemplos a fin de interpretar ambos tipos de enlaces:
En los átomos que forman enlaces se puede observar lo siguiente:
El átomo de litio, al perder un electrón, queda con dos electrones, tomando la configuración del helio, mientras que el flúor, al ganar un electrón, queda con ocho electrones en su capa de valencia, tomando la configuración del neón. En el caso del hidrógeno, que tiene un electrón, al formar enlace presenta dos electrones como el helio.
Así, en la mayoría de los casos, para tomar la configuración del gas noble más próximo, se perderán, o ganarán o compartirán tantos electrones hasta quedar con dos (hidrógeno, litio) u ocho electrones en la capa de valencia. En este último caso, que es el más común, se dice que el átomo completa el octeto.
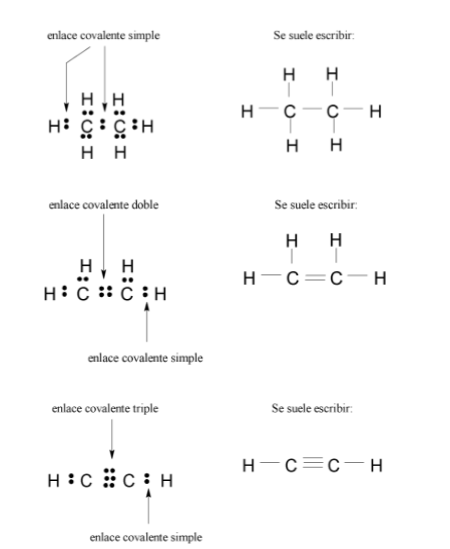
Por otro lado, es importante indicar que el enlace covalente puede ser, además de simple como en la molécula de hidrógeno, doble o triple.
Ejemplos:
3. Teoría del enlace de valencia
Para establecer la estructura según la Teoría del Enlace de Valencia, se debe considerar la hibridación del carbono, entendiéndose por hibridación la mezcla y reorientación en el espacio de orbitales atómicos.
Es importante aclarar que la hibridación de orbitales atómicos puros da por resultado orbitales atómicos no puros o híbridos.
Si bien la hibridación es el resultado de cálculos complejos realizados por la Mecánica Cuántica, en este curso sólo veremos las conclusiones del análisis.
Las ideas clave de esta teoría son las siguientes:
-
Los enlaces covalentes se forman por traslape (solapamiento) de dos orbitales atómicos (puros o híbridos), cada uno de los cuales tiene un electrón con espines opuestos.
-
Cada átomo enlazado retiene sus orbitales atómicos, y el par de electrones con espines opuestos comparte el espacio común entre ambos núcleos. Los electrones de la región de solapamiento, son atraídos simultáneamente por ambos núcleos, lo que mantiene unidos a los átomos.
-
Mientras mayor es el traslape de orbitales, el enlace es más fuerte.
-
Los enlaces que se forman por el traslape de frente de dos orbitales atómicos a lo largo de una línea que une ambos núcleos, se llaman enlaces sigma (σ).
-
Los enlaces tipo pi (π) se forman por solapamiento lateral de dos orbitales atómicos.
-
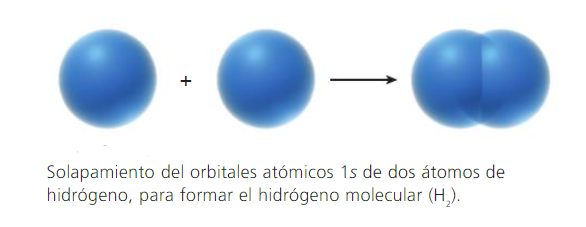
-
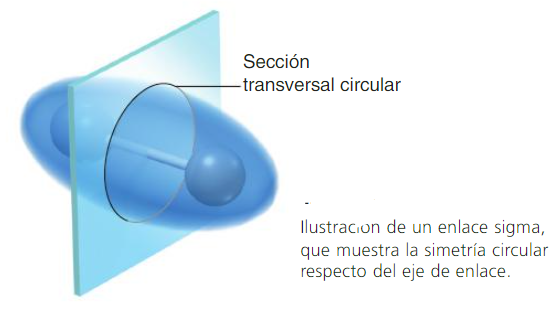
-
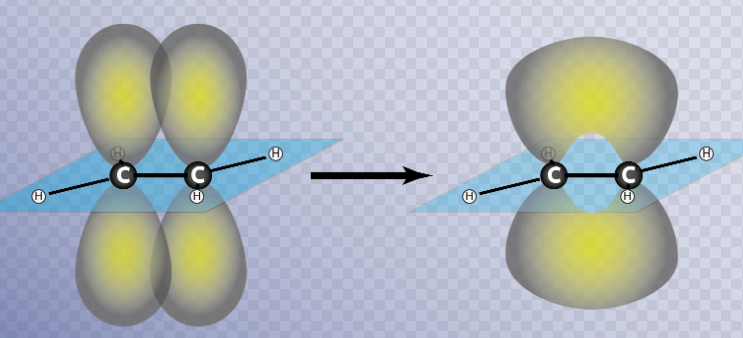
Los invitamos a visualizar los videos del profesor Ernesto Brunet Romero para conocer las hibridaciones del C que trabajaremos en las siguientes unidades
4. Teoría de la resonancia
- Resonancia es, básicamente, deslocalización de electrones pi.
- La resonancia o deslocalización de electrones se presenta en moléculas con dobles o triples enlaces conjugados (ej.: 1,3-butadieno), pero también en otras especies químicas como radicales libres, aniones y cationes

Hay pruebas (ej.: longitudes de enlaces) que demuestran, que por sí mismas cada una de ellas no representa a la especie química correspondiente. No se observa que en cada una hay deslocalización de electrones pi. Por ejemplo, si tuviéramos que escribir la estructura del 1,3-butadieno, pondríamos:
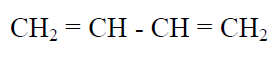

Sin embargo esta no es la verdadera estructura del compuesto, ya que al poseer dobles enlaces conjugados, presentaría deslocalización de electrones pi. Por lo tanto la estructura dada, por sí misma, no representaría al compuesto. Podríamos haber escrito distintas estructuras con distintas posiciones de los electrones móviles (pi), pero ninguna en forma aislada representaría al compuesto:


Entonces, la Teoría de la Resonancia postula que “si pueden escribirse dos o más estructuras correspondientes a un mismo compuesto, que difieran únicamente en las posiciones de los electrones, ninguna de las estructuras estará en concordancia con las propiedades del compuesto y, por lo tanto, no lo representa”.
Cuando hay conjugación una única estructura no representa al compuesto porque en los dobles enlaces, además de los electrones sigma que están más retenidos compartidos entre dos núcleos, los pi están menos retenidos. Entonces si esos electrones pertenecen a un doble enlace aislado, es compartido por dos núcleos, estando menos retenidos que los sigma (ej.: eteno). Pero si hay conjugación, en realidad esos electrones móviles pasan a moverse por toda la zona donde hay conjugación (ej.: 1,3-butadieno).
La Teoría de la Resonancia propone que esas estructuras sean utilizadas como "contribuyentes" a la estructura real, y las llama estructuras contribuyentes, o canónicas o de resonancia. No son estructuras reales.
¿Cómo representamos al compuesto?
Escribiendo las estructuras contribuyentes, que pueden ser dos o más, y entre dos estructuras se coloca una flecha de dos puntas que es el símbolo de la resonancia. Por ejemplo, al 1,3-butadieno lo representaremos como sigue:
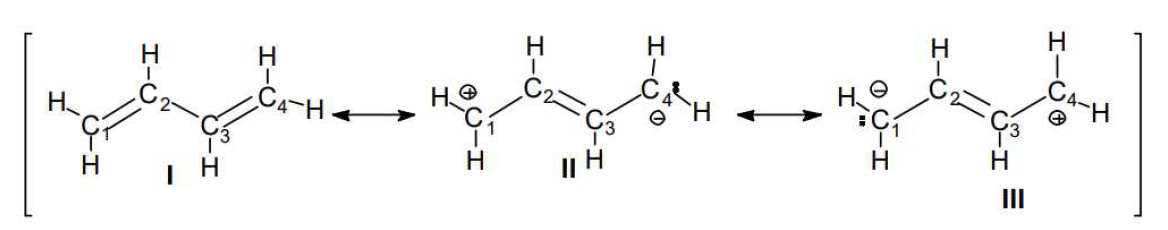

Tratemos de comprender mediante un ejemplo a escala mayor, como es el caso de un objeto que se mueve (ej.: una pelota de fútbol que cae desde un muro). Si nosotros quisiéramos dibujar en un papel a la pelota cayendo desde el muro, no podríamos. Pero sí podemos hacer una secuencia con distintas posiciones de la pelota y el conjunto nos dará la idea de la caída:
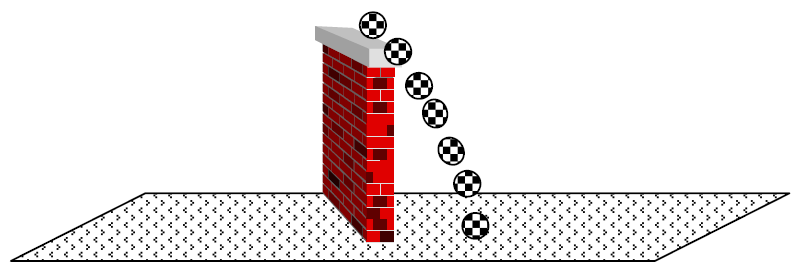

Ninguna de las pelotas en forma aislada representa la caída, pero el conjunto da idea del movimiento. Así, como no se puede representar en el plano el movimiento de los electrones en el 1,3-butadieno, se escriben distintas estructuras, cada una de las cuales por sí misma no indica el movimiento de los electrones, pero en conjunto dan idea del mismo.
La TEV, establecida con posterioridad a la Teoría de la Resonancia, permite comprender mejor la deslocalización de electrones.
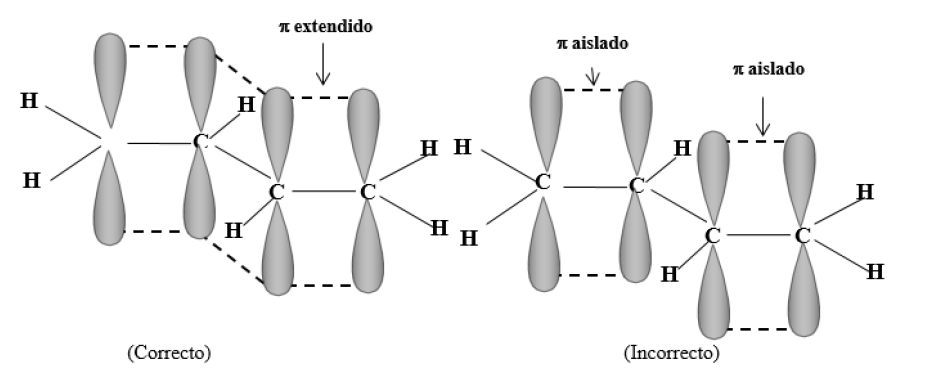
Por ejemplo, en el 1,3-butadieno todos los carbonos tienen hibridación sp2. Se forman los enlaces sigma orientados en un mismo plano, por solapamiento de orbitales híbridos entre sí (enlaces C1 - C2 , C2 - C3 , C3 - C4 ) y de orbitales híbridos con 1s de hidrógeno (enlaces C-H).
A cada carbono le queda un orbital pz con un electrón y, además, todos estos orbitales p están paralelos, lo que permite la formación de una nube pi extendida (cada orbital p se puede solapar con los dos orbitales p vecinos), ocupada por los electrones que originalmente eran pz (cada electrón se mueve en un espacio mayor, asociado a cuatro núcleos, que el que correspondería a un pi aislado):