ISOMERÍA
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curso: | Química Orgánica 2023 |
| Libro: | ISOMERÍA |
| Imprimido por: | Cuenta visitante |
| Día: | domingo, 1 de febrero de 2026, 17:25 |
1. Introducción
Los isómeros son compuestos diferentes de igual fórmula molecular.
Básicamente, hay dos tipos de isomería, la isomería plana y la isomería espacial.
Los invitamos a visualizar el siguiente video del profesor Ernesto Brunet Romero
2. Isomería plana
Isómeros planos son aquellos compuestos que tienen igual fórmula molecular pero distinta fórmula estructural.
Es decir, escribiendo sus estructuras en un plano (ej: papel, pizarra) determinamos que se trata de compuestos distintos.
Hay diferentes tipos de isómeros planos:
Isomería de cadena
Estos isómeros presentan distintas cadenas carbonadas, lo que determina diferencias en sus propiedades físicas.
El profesor Ernesto Brunet Romero en este video explica este tipo de isomería
Isomería de posición
Son compuestos cuyas estructuras se diferencian en la posición del Grupo Funcional (ej: alquenos, alcoholes).
Ejemplo: Compuestos de fórmula molecular C4 H8 de cadena abierta lineal.
En este caso, los isómeros presentan distinta posición del doble enlace, que es el grupo funcional de la familia a la que pertenecen.
Los isómeros de posición presentan distintas propiedades, principalmente físicas.
Isomería de función
Son compuestos que tienen igual fórmula molecular, pero pertenecen a series homólogas diferentes por poseer grupos funcionales distintos (ej: aldehídos y cetonas).
Ejemplo: Compuestos de fórmula molecular C3H6O
Otro ejemplo se presenta entre alcoholes y éteres.
Ejemplo: Compuestos de fórmula molecular C2H6O
En estos casos, los isómeros presentan distintos grupos funcionales, por lo que no sólo difieren en propiedades físicas, sino también en propiedades químicas.
Les dejamos un video del profesor Ernesto Brunet Romero
3. Isomería espacial o estereoisomería
Son isómeros espaciales aquellos compuestos que tienen igual fórmula molecular, igual fórmula estructural, pero diferente orientación de los átomos en el espacio.
3.1. Isomería conformacional
3.2. Isomería geométrica
3.3 Isomería óptica3.1. Isomería conformacional
Conformaciones del etano
Construyendo un modelo molecular del etano comprobaremos que los dos grupos metilo pueden rotar fácilmente uno respecto al otro. La energía necesaria para mover los átomos de hidrógeno de un metilo respecto del otro, o barrera de rotación, es de 2.9 kcal/mol. Este valor es tan pequeño que los químicos hablan de libre rotación de los grupos metilo. En general, hay rotación libre alrededor de todos los enlaces simples.
La conformación producida por la rotación respecto al enlace carbono-carbono del etano representa un continuo entre los dos extremos que se muestran arriba: una conformación alternada o escalonada y una conformación eclipsada. Entre estos dos extremos hay una cantidad infinita de conformaciones posibles.
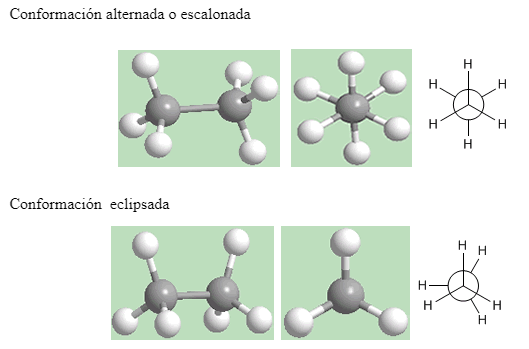
La conformación alternada es más estable, y por consiguiente su energía es menor que la conformación eclipsada. La conformación de una molécula cambia millones de veces por segundo, de alternada a eclipsada, a temperatura ambiente. Debido a esta interconversión continua, no se pueden separar entre si los diferentes confórmeros, aunque algunos tienen más probabilidad de persistir que otros.
Les dejamos un video del profesor Ernesto Brunet Romero
Conformaciones del ciclohexano
Los compuestos cíclicos más frecuentes en la naturaleza contienen anillos de seis miembros. La conformación más favorecida para el ciclohexano es la conformación de silla, un ordenamiento que casi está libre de tensión, donde todos los ángulos de enlace son de 111°, muy cercanos al ángulo tetraédrico ideal de 109,5° y todos los hidrógenos unidos sobre carbonos adyacentes se encuentran perfectamente escalonados. En la conformación de silla, los hidrógenos del ciclohexano pueden ser de dos clases, que reciben los nombres de axiales y ecuatoriales. El ciclohexano se interconvierte rápidamente entre confórmeros silla estables por la facilidad de rotación respecto a sus enlaces C-C.
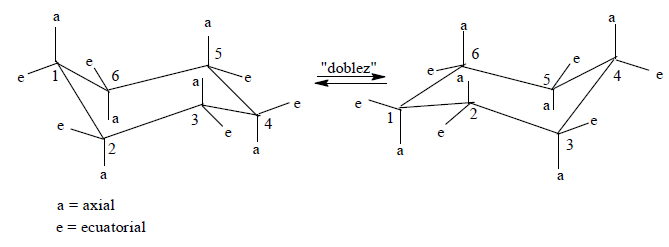
Los enlaces axiales de la estructura de la izquierda, se convierten en enlaces ecuatoriales en la estructura de la derecha, cuando el anillo se "dobla". En este compuesto, también existe una conformación de bote, la cual no resulta tan estable porque algunos de los enlaces se encuentran eclipsados.
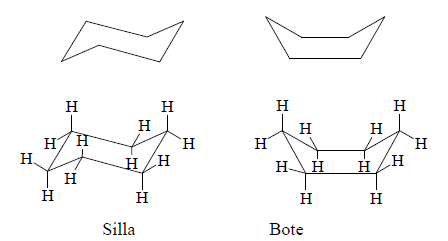
Les dejamos un video del profesor Ernesto Brunet Romero
3.2. Isomería geométrica
Este tipo de isomería se debe al impedimento a la rotación en torno de un doble enlace (C=C o C=N). Recordemos que el enlace π se forma sólo si los orbitales p son paralelos. Para que haya rotación se debería romper el enlace π, y éste podría volver a formarse cuando los orbitales p quedaran nuevamente paralelos.
Como consecuencia del impedimento a la libre rotación en un doble enlace, las configuraciones (I) y (II) son distintas y cada una responde a un compuesto determinado:
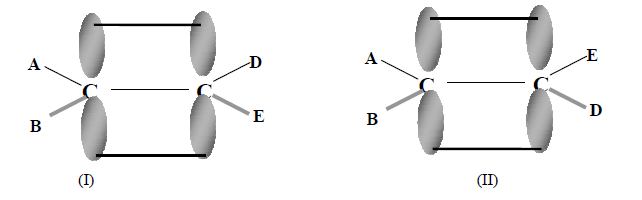
Aunque se gire (II) en torno de distintos ejes, nunca coincidirá con (I). Son dos configuraciones diferentes. Se dice que no son superponibles, y se las llama diasterómeros. Ejemplo: Compuestos de fórmula molecular C4H8 y estructura CH3-CH=CH-CH3 (2-buteno), se presenta en dos formas diferentes:
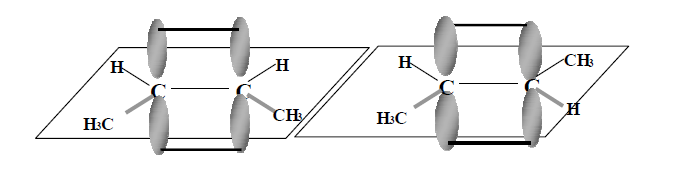
Una representación más simple es la siguiente:

Cis significa “del mismo lado”, mientras que trans “de lados opuestos”. Es decir, en el cis-2-buteno los grupos metilo están del mismo lado del plano perpendicular al plano donde se orientan los enlaces σ y en el trans 2-buteno los grupos metilo están de lados opuestos respecto al mismo plano.
Al principio hablamos del impedimento a la rotación en torno al doble enlace, pero hay otra condición para que haya isomería geométrica y es que cada carbono del doble enlace debe ir unido a dos átomos o grupos de átomos distintos. Es decir, para que haya isomería geométrica se debe cumplir:
1º Existencia de doble enlace (C=C ó C=N).
En este curso consideraremos sólo compuestos con enlaces C=C, pero debemos tener en cuenta que también puede haber isomería geométrica con unión C=N.
2º Cada carbono del doble enlace debe ir unido a dos átomos o grupos de átomos distintos. Los ejemplos siguientes explican por qué para que haya isomería geométrica se debe cumplir también esta segunda condición:
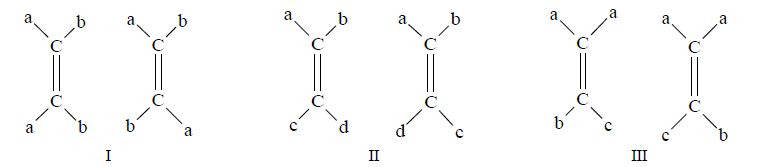
(I) Son dos configuraciones distintas, aunque movamos según distintos ejes una de las moléculas nunca coincidirá con la otra. Se trata de dos isómeros.
(II) Son dos configuraciones distintas, aunque movamos según distintos ejes una de las moléculas nunca coincidirá con la otra. Se trata de dos isómeros.
En (III) no hay isomería, hemos representado al mismo compuesto dos veces. Si imaginamos un eje paralelo al papel y giramos la segunda molécula, observamos que coincide con la primera.
Les dejamos un video del profesor Ernesto Brunet Romero
Sistema E-Z
Cuando encontramos compuestos como el 1-bromo-2-cloropropeno, en donde los cuatro sustituyentes son diferentes no se puede usar el sistema cis-trans de nomenclatura. Para este tipo de compuestos se inventó el sistema Z-E
Para dar nombre a un isómero con esta nomenclatura se trabaja de la siguiente manera:
Se determinan las prioridades relativas de los dos grupos unidos a cada uno de los carbonos sp2. Dicha prioridad se determina según el número atómico de los átomos directamente unidos a cada uno de los C que participan del doble enlace. El átomo de mayor número atómico tiene la mayor prioridad.
Si el doble enlace presenta los dos grupos de mayor prioridad del mismo lado del plano de referencia se le asigna la configuración Z (del alemán zusammen) Cis: (Si los grupos son iguales)
Si el doble enlace presenta los dos grupos de mayor prioridad de lados opuestos del plano de referencia se le asigna la configuración E (del alemán entgegen) Trans: (Si los grupos son iguales)
Entonces en el 1-bromo-2-cloropropeno uno de los carbonos sp2 está unido a un Br y un H. El número atómico del bromo es mayor que el del hidrógeno, de modo que el Br es el de mayor prioridad. El otro carbono sp2 está unido a un Cl y a un C. El cloro tiene el número atómico mayor, por lo que es el prioritario.

Si los dos grupos unidos a un carbono sp2 comienzan en el mismo átomo (hay un empate) habrá que alejarse del punto de unión y tener en cuenta los números atómicos de los átomos unidos a los átomos empatados
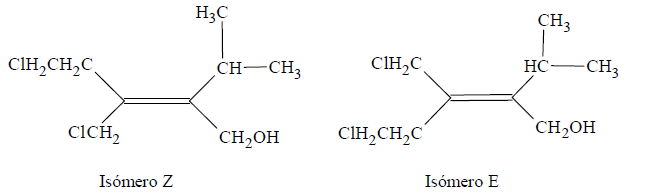
El C del grupo CH2Cl está unido a Cl, H, H y el C del grupo CH2CH2Cl está enlazado con C, H, H. El Cl tiene mayor número atómico que el C, de manera que el grupo CH2Cl tiene mayor prioridad. Lo mismo ocurre con los sustituyentes del otro C con hibridación sp2 siendo el grupo prioritario CH2OH por poseer el O el mayor número atómico.
Les dejamos un video del profesor Juan Antonio Llorens Molina
3.3. Isomería óptica
Los isómeros ópticos son moléculas que coinciden en todas sus propiedades excepto en la capacidad de desviar el plano de luz polarizada. Es por esto, que el tipo de isomería más interesante es el que da lugar a la actividad óptica.A principios de siglo XIX el físico Jean-Baptiste Biot señaló que algunas sustancias orgánicas de origen natural poseían la propiedad de girar el plano de la luz polarizada. Este fenómeno consiguió explicarse cuando los químicos comenzaron a considerar la disposición tridimensional de las moléculas en el espacio y la configuración tetraédrica del átomo de carbono
Las propiedades geométricas de un carbono con hibridación sp3 hacen que, en el caso de que esté unido a cuatro átomos o grupos de átomos diferentes, la molécula no tenga plano de simetría y que existan dos maneras diferentes de ordenar a los cuatro átomos o grupos de átomos. Éstas dos configuraciones originan dos formas isoméricas especulares no superponibles llamadas enantiómeros.
El carbono con hibridación sp3 que está unido a cuatro átomos o grupo de átomos diferentes se denomina centro quiral o estereocentro. Cuando se presenta este caso se dice que la molécula es quiral y ópticamente activa, ya que es capaz de desviar el plano de la luz polarizada.
De esta forma, se dice que dos enantiómeros se diferencian por:
- Sus propiedades químicas son idénticas, salvo frente a reactivos ópticamente activos.
- Sus propiedades físicas son iguales, excepto la dirección de rotación del plano de la luz polarizada.
La dirección de rotación de dos enantiómeros es distinta, pero de igual magnitud. Por lo tanto la rotación específica de uno de ellos es (+) y la del otro (-), pero el valor absoluto es igual.
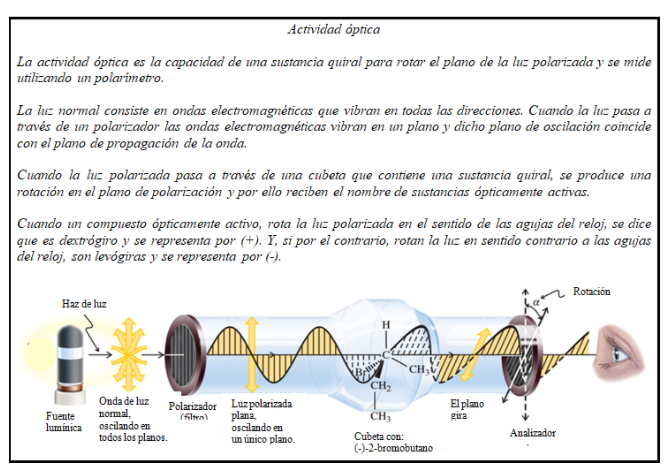
Rotación específica
Cuando la luz polarizada plana atraviesa una sustancia quiral, el campo eléctrico interacciona de modo diferente con lo que podríamos llamar mitades “izquierda” y “derecha” de la molécula. Esta diferente interacción da como resultado una rotación del plano de polarización denominada rotación óptica y la muestra que la provoca se dice que es ópticamente activa.
La rotación medida (en grados) en el polarímetro, es la rotación óptica observada, α, de la muestra. Su valor es función de la concentración y de la estructura de la molécula activa, de la longitud de la cubeta que contiene la muestra, de la longitud de la onda de luz incidente, del disolvente y de la temperatura. Con el fin de evitar ambigüedades se ha establecido un valor estándar de α, el cual se conoce como rotación específica, [α] característica de cada compuesto.
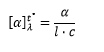
Donde:
[a] = Rotación específica
l = Longitud de onda de la luz incidente; la fuente de luz más común es la correspondiente a la línea D de una lámpara de vapor de sodio (l = 589,3 nm).
T = temperatura en ºC.
a = Rotación observada.
L = Longitud de la cubeta que contiene la muestra, en dm.
c = concentración en gramos por mL de disolución.
Recordar: La rotación específica es una constante física característica de las moléculas ópticamente activas.
Los enantiómeros giran el plano de la luz polarizada el mismo ángulo pero en sentidos opuestos.
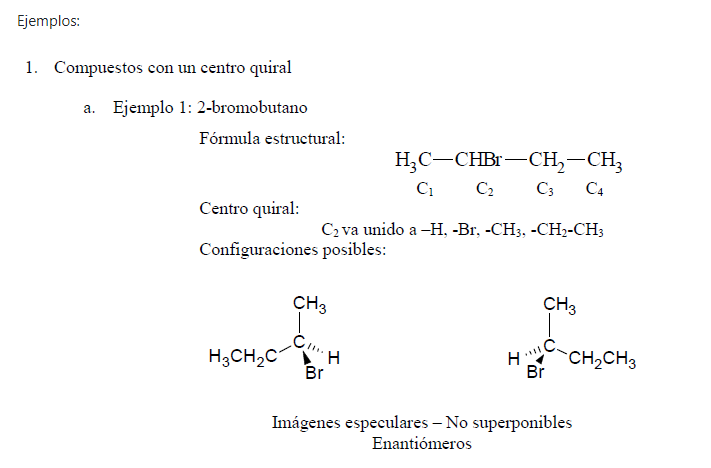
Un compuesto que tiene un centro asimétrico (como el 2-bromobutano) puede existir en forma de dos estereoisómeros. Si se imagina un espejo entre los dos estereoisómeros podrá verse que son imágenes especulares entre sí. Además, son imágenes especulares no superponibles y por consiguiente son moléculas diferentes.
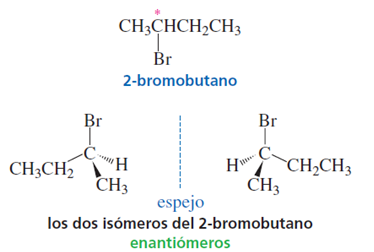
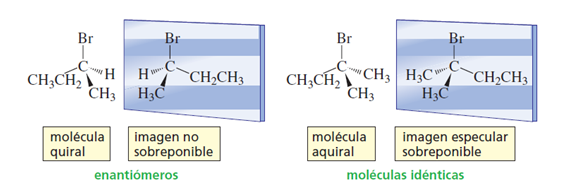
Las moléculas que son imágenes especulares no sobreponible entre sí se llaman enantiómeros (del griego enantion, “opuesto”). Así, los dos estereoisómeros del 2-bromobutano son enantiómeros. Una molécula que tiene imagen especular no sobreponible, como un objeto que tiene imagen especular no sobreponible, es quiral. Por consiguiente, cada miembro de un par de enantiómeros es quiral. Téngase en cuenta que la quiralidad es una propiedad de todo un objeto o de toda una molécula.
Una molécula que tiene una imagen especular sobreponible, como un objeto que tiene una imagen especular sobreponible, es aquiral.
Una mezcla 1:1 de enantiómeros (+) y (-) no presenta rotación óptica y es por lo tanto ópticamente inactiva. Este tipo de mezcla se denomina mezcla racémica.
Los invitamos a visualizar los videos del profesor Ernesto Brunet Romero
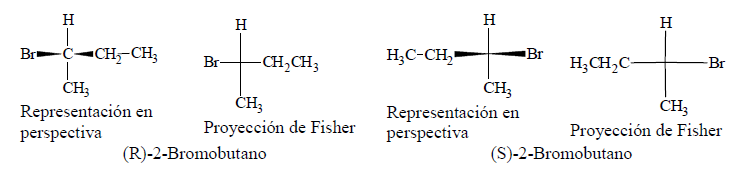
Cuando estamos en presencia de distintos estereoisómeros de un compuesto, nos preguntamos cuáles son los nombres que identifican a cada uno de ellos. Para evitar confusiones, es necesario utilizar un sistema de nomenclatura que indique el ordenamiento de los átomos o grupos en torno al centro asimétrico. Por este motivo, en química se emplean las letras R y S. Este sistema fue inventado por R. S. Cahn, C. Ingolg y V. Prelog.
Antes de aplicar esta nomenclatura a un estereocentro, se deben asignar prioridades a los sustituyentes mediante el uso de reglas de secuencia.
Regla 1: Se consideran los átomos directamente unidos al estereocentro. Un sustituyente con mayor número atómico tiene preferencia sobre los de número atómico inferior. Cuando dos sustituyentes tienen idéntica prioridad, se exploran las cadenas de dichos sustituyentes hasta encontrar un punto de diferencia. Los dobles o triples enlaces se tratan como si fueran sencillos, duplicando o triplicando los átomos de la cadena.
Regla 2: Orientar la molécula de modo que el átomo o grupo que tenga la prioridad menor se aleje del espectador. A continuación trazar una flecha imaginaria del grupo o átomo con la mayor prioridad hasta el grupo o átomo con la siguiente prioridad mayor.
1. Si la flecha apunta en el sentido de las manecillas del reloj, el centro asimétrico tiene la configuración R (Rectus en latín: Derecho).
2. Si la flecha apunta en contra del sentido de las manecillas del reloj, el centro tiene una configuración S (Sinister en latín: Izquierdo).
Les dejamos un video del profesor Juan Antonio Llorens Molina. Estereoisomería óptica. Asignación de las configuraciones R/S a los centros quirales
Fórmulasde Fischer
Una proyección de Fischer es una forma simplificada de representar, en dos dimensiones, átomos de carbono tetraédricos y sus sustituyentes. En este método, la molécula se dibuja en forma de cruz, con el átomo central en el punto de intersección. Por convenio, las líneas horizontales representan enlaces dirigidos hacia el observador, y las verticales enlaces que se alejan de éste. Las moléculas en perspectiva deben disponerse de esta forma para facilitar su transformación en proyecciones de Fischer.
Un ejercicio mental sencillo para transformar representaciones en perspectiva en proyecciones de Fisher es el siguiente:
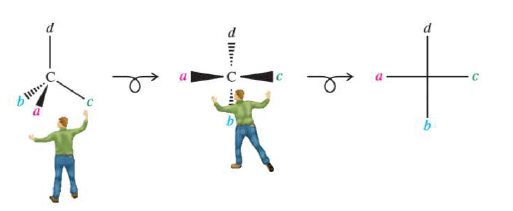
Una vez obtenida la proyección de Fisher, puede interconvertirse en otras equivalentes mediante ciertas rotaciones y permutaciones de sustituyentes. Sin embargo hay que tener mucho cuidado de que tales manipulaciones no alteren la configuración del estereocentro.
Ahora vamos a revisar la manera de determinar la configuración en un compuesto representado como proyección de Fischer.
1. Ordene los grupos que estén enlazados al centro asimétrico por prioridad decreciente.
2. Trace una flecha desde el grupo con la mayor prioridad hasta el grupo con la siguiente prioridad mayor. Si la flecha apunta en el sentido de las manecillas del reloj, el enantiómero presenta configuración R, si apunta en sentido contrario a las aguas del reloj, el enantiómero tiene la configuración S, siempre y cuando el grupo con la menor prioridad esté en un enlace vertical.
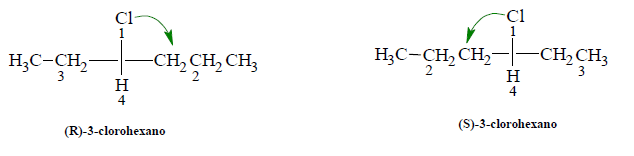
Si el grupo con la menor prioridad está en el enlace horizontal, lo que indica la dirección de la flecha será contrario a lo correcto. En el ejemplo que sigue, el grupo con menor prioridad está en un enlace horizontal, por lo que el sentido de las manecillas indica la configuración S y no la configuración R.

Al trazar la flecha del grupo 1 al grupo 2, se la puede hacer pasar por el grupo con la menor prioridad (4), pero nunca debe dibujarse haciéndola pasar por el grupo con la siguiente prioridad menor (3)

Los enantiómeros giran el plano de la luz polarizada el mismo ángulo pero en sentidos opuestos. Así, para el 2-bromobutano el enantiómero (-) gira el plano 23,1º en sentido antihorario, y su imagen especular (+)-2-bromobutano lo hace 23,1º en sentido horario. De aquí se desprende que una mezcla 1:1 de enantiómeros (+) y (-) no presenta rotación óptica y es por lo tanto ópticamente inactiva. Este tipo de mezcla se denomina mezcla racémica.
2. Compuesto con más de un centro quiral
a. Ejemplo 1: 3-cloro-2-butanol
Muchos compuestos orgánicos tienen más de un centro asimétrico. Cuantos más centros asimétricos tenga un compuesto, más estereoisómeros puede tener. Conociendo el número de centros asimétricos que tiene un compuesto es posible calcular el número máximo de estereoisómeros del mismo:
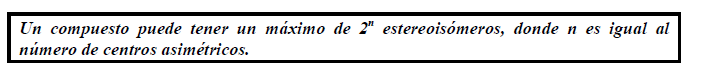
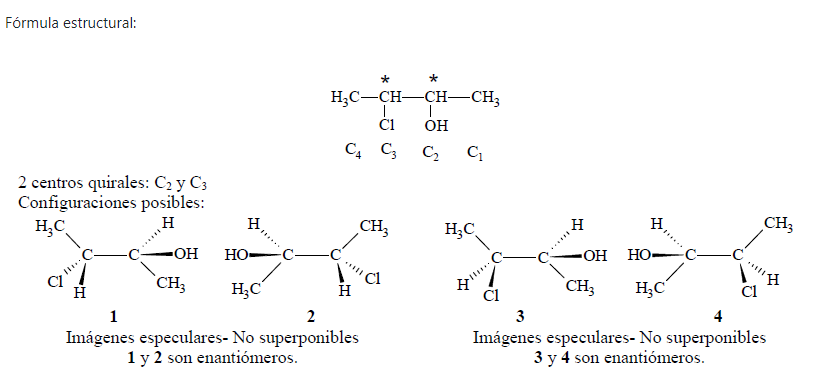
1 y 3 son esteroisómeros que no son idénticos y tampoco son imágenes especulares; se llaman diasterómeros. Los diasterómeros son estereisómeros que NO son enantiómeros. Las configuraciones 1 y 4, 2 y 3, 2 y 4, también son diasterómeros.
Los diasterómeros tienen propiedades físicas distintas (distintos puntos de fusión, de ebullición, solubilidad, rotaciones específicas, entre otras) y distintas propiedades químicas.
Formas meso
Algunos compuestos con dos centros asimétricos tienen solamente 3 estereoisómeros en lugar de 4, es por ello que se dice que el máximo número de estereoisómeros que puede tener un compuesto con n centros asimétricos es 2n.
Un ejemplo de lo anterior es el compuesto 2,3-dibromobutano.
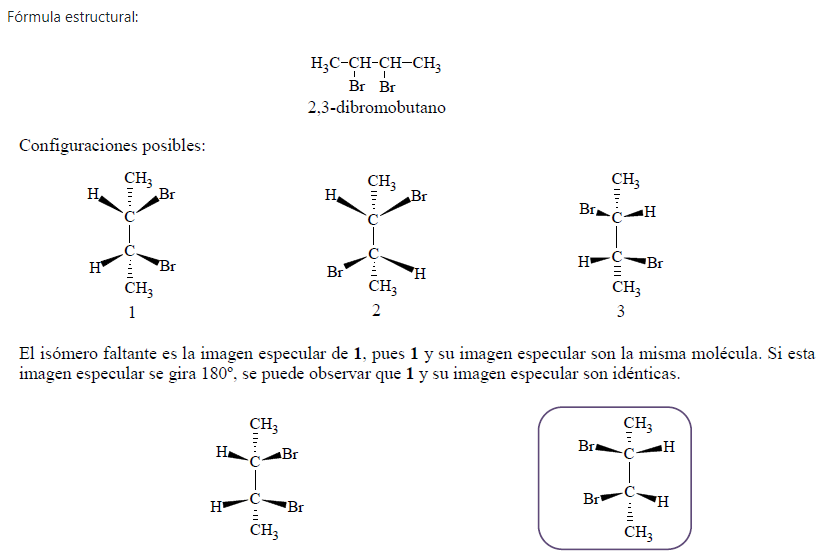
Al estereoisómero 1 se le denomina compuesto meso. El compuesto meso es una molécula aquiral a pesar de contar con centros asimétricos. Esta molécula no provoca giros en el plano de la luz polarizada ya que es superponible con su imagen especular.
Un compuesto meso se reconoce por el hecho de que tiene dos (o más) centros asimétricos y un plano de simetría. Dicho plano corta la molécula por el centro y una mitad es la imagen especular de la otra. El estereoisómero 1 tiene un plano de simetría, por lo tanto no tiene un enantiómero.
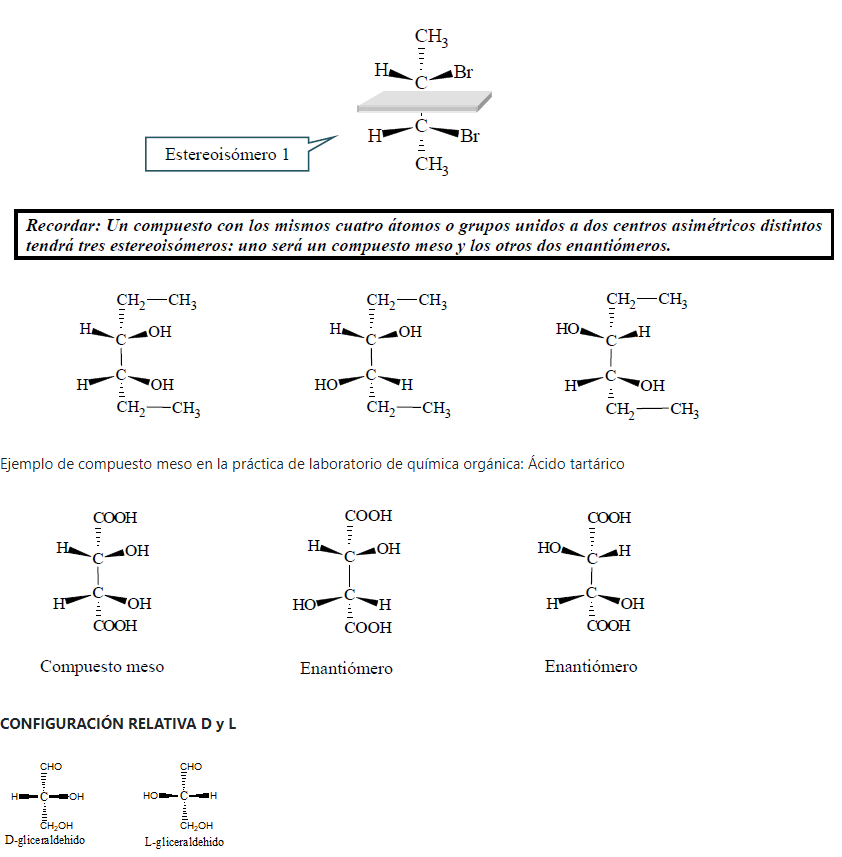
La configuración D-L solamente indica que el compuesto tiene la misma configuración que el D ó L gliceraldehído (con el OH hacia la derecha o hacia la izquierda, respectivamente).
Les dejamos un video del profesor Juan Antonio Llorens Molina. Estereoisómeros ópticos con dos carbonos asimétricos