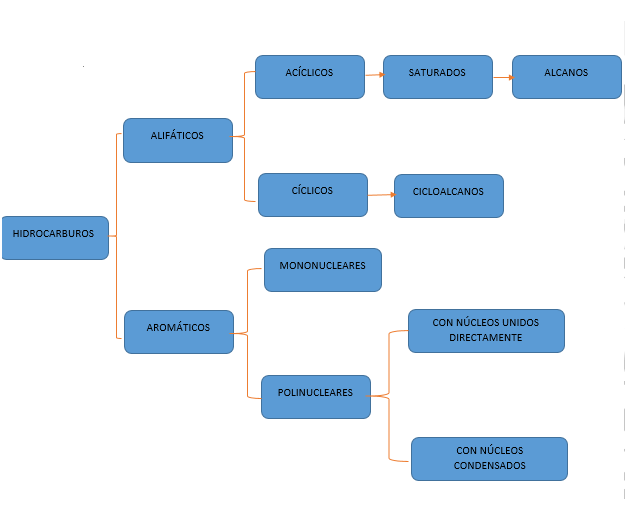
HIDROCARBUROS
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curso: | Química Orgánica 2023 |
| Libro: | HIDROCARBUROS |
| Imprimido por: | Guest user |
| Día: | domingo, 1 de febrero de 2026, 12:52 |
1. INTRODUCCIÓN
El petróleo constituye una de las principales fuentes naturales de hidrocarburos, los cuales son indispensables en la sociedad actual. Por esta razón dedicaremos gran parte de la Unidad 2 a conocer su origen, familias orgánicas que lo componen y sus propiedades físicas. También revisaremos las zonas geográficas de la Argentina que poseen este recurso y sus características.
Para ello utilizaremos como información los apuntes de Química Orgánica, y archivos publicados por la Secretaría de Energía de la Nación
Origen del Petróleo
El petróleo es un combustible fósil que se formó hace millones de años durante un largo proceso, en el cual, la materia orgánica (vegetal y animal, principalmente de origen marino) se fue almacenando en cuencas de sedimentación de zonas costeras. Estos depósitos fueron cubiertos por capas sucesivas de arena, arcilla y barro que, con el tiempo se endurecieron. Bajo estas circunstancias, la degradación de la materia orgánica ocurrió lentamente, debido principalmente a la escasez de oxígeno y gracias a microorganismos como las bacterias anaerobias. Sumado a la falta de oxígeno, las elevadas presiones y temperaturas, dieron como resultado la formación de petróleo. El petróleo crudo, es decir, en estado natural, se encuentra embebido en las rocas porosas de la corteza terrestre, semejante al agua en una esponja, y no a manera de lagos subterráneos, como tiende a pensarse. Se trata de una mezcla de hidrocarburos de diferentes pesos moleculares, en estado sólido, líquido y gaseoso, además de pequeñas cantidades de azufre, nitrógeno y oxígeno. (Fuente Hipertexto Química 2. Editorial Santillana)
Familias químicas que lo componen
2. ALCANOS
Para estudiar este tema les proponemos que exploren el material en el orden que les indicamos a continuación:
Estructura y nomenclatura: http://qorganica.es/QOT/T2/estructura_alcanos_exported/index.html
Propiedades físicas: http://www.qorganica.es/QOT/T2/pfis_alcanos_exported/index.html
Conformaciones: http://qorganica.es/QOT/T2/conformaciones_exported/index.html
Reacciones
A partir de esta Unidad, veremos las reacciones más comunes que se producen en un grupo funcional. Los invitamos a ver el video del Profesor Brunet sobre reactividad.
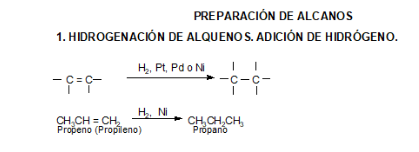
Preparación de alcanos
Como ya dijimos en la Introducción de Hidrocarburos, los alcanos y cicloalcanos se obtienen principalmente del petróleo.
Les invitamos a visualizar este video que expone de donde proviene el petróleo y como se extrae.
Y este video donde se puede comprender los procesos que se realizan en una refinería para separar fracciones de hidrocarburos de uso industrial.
Otras formas de preparar alcanos

Pirólisis (cracking)
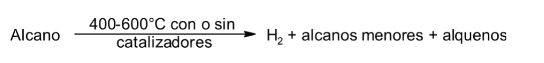
Es la descomposición de un compuesto por el calor. Cuando los alcanos se hacen pasar sobre un catalizador a 500ºC - 600ºC en ausencia de aire (para impedir la combustión), tienen lugar rupturas de los enlaces C-H o C-C de las moléculas. Se originan entonces radicales que rápidamente se recombinan produciendo una mezcla compleja de alcanos (muchos de ellos ramificados), alquenos e hidrógeno.
A continuación les ofrecemos un video preparado por la cátedra sobre crackeo, pirólisis o cracking.
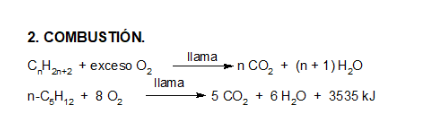
Combustión
3. ALQUENOS
Los alquenos también son hidrocarburos, ya que sólo están formados por átomos de carbono e hidrógeno, pero se diferencian de los alcanos por la presencia de dobles enlaces.Debido a que estos compuestos son capaces de tomar H2 para transformarse en hidrocarburos saturados (alcanos) se los conoce con el nombre general de hidrocarburos insaturados.
En este video se presentan los alquenos hasta cuatro átomos de carbono, su estructura, su nomenclatura y los tipos de isomería que presentan.
En este video se presenta la hibridación de los alquenos y sus propiedades de enlace.
Nomenclatura
http://www.qorganica.es/QOT/T4/nomenclatura_alquenos_exported/index.html
Propiedades físicas
http://www.qorganica.es/QOT/T4/pfis_alquenos_exported/index.html
Reacciones
Preparación de alquenos
1. DESHIDROHALOGENACIÓN DE HALOGENUROS DE ALQUILO


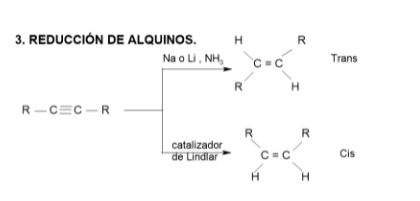
http://www.qorganica.es/QOT/T4/reduccion_alquinos_exported/index.html
REACCIONES DE ADICIÓN
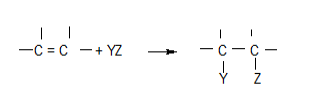
Una reacción de adición es aquella en la cual dos moléculas se unen entre sí (se adicionan) para formar una mayor. Nada se pierde en este proceso, ya que todos los átomos de las moléculas originales están formando parte de la nueva molécula obtenida. Además, para que estas reacciones tengan lugar es necesario que al menos uno de los reactivos posea un doble o un triple enlace.
Las reacciones de adición pueden ser homolíticas (por radicales libres) y heterolíticas (iónicas).
Si las reacciones son heterolítcas suelen clasificarse además en nucleofílicas o electrofílicas según las características del reactivo atacante.
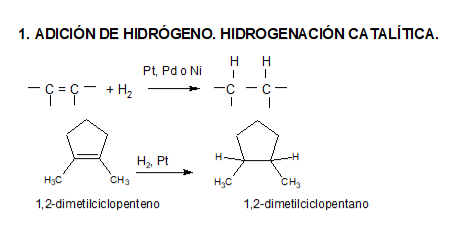
Acá estudiaremos la adición por radicales libres en alquenos. En el caso de los alquinos el mecanismo es igual pero, en lugar de la adición de una molécula, se pueden adicionar dos.
Recordemos que los alquenos poseen un doble enlace que consiste en una unión σ fuerte y una π débil, por lo que es de esperar que los radicales libres puedan utilizar electrones de la nube π.
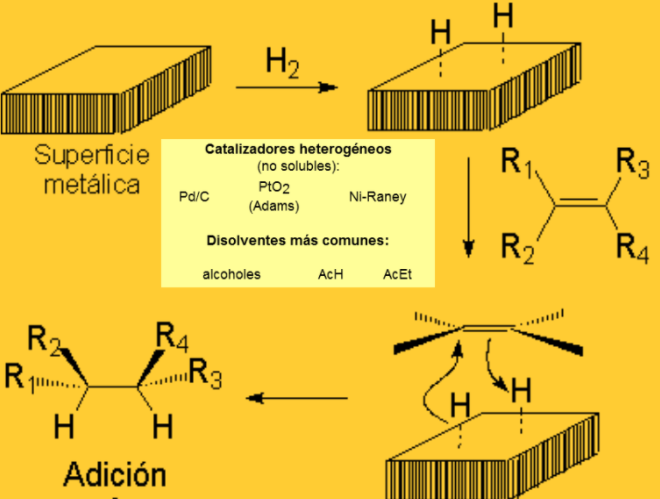
La hidrogenación puede realizarse por dos métodos distintos (reacción heterogénea y reacción homogénea). En ambos casos, el catalizador provoca la adición de hidrógeno molecular al doble enlace.
Hidrogenación heterogénea (dos fases)
Es el método clásico, todavía muy utilizado. El catalizador es un metal finamente dividido, por lo común platino, paladio o níquel.
Se agita una solución del alqueno bajo una ligera presión de hidrógeno en presencia de una pequeña cantidad del catalizador. La reacción es rápida y suave y, una vez completada, se separa mediante filtración el producto saturado del catalizador.

Hidrogenación homogénea (una fase)
Este método es mucho más moderno y ofrece una flexibilidad imposible de alcanzar con los catalizadores antiguos. Mediante modificaciones en los catalizadores, puede llevarse a cabo la hidrogenación con una gran selectividad.
Los catalizadores son complejos orgánicos de metales de transición, como rodio o iridio (ej.: catalizador de Wilkinson). Los mismos son solubles en disolventes orgánicos y la hidrogenación se efectúa así en una sola fase. El inconveniente del método es la dificultad de separación del catalizador y el producto una vez terminada la reacción. Sin embargo, se están realizando estudios para resolver esta dificultad: el catalizador va incorporado químicamente a un polímero sólido insoluble, lo que permite una filtración fácil al final de la reacción. De esta manera, la hidrogenación homogénea se convierte en heterogénea, pero el modo de acción parece permanecer igual.
Calor de hidrogenación
La hidrogenación es exotérmica, porque los dos enlaces σ (C-H) que se forman liberan más energía que la que se absorbe al romperse los enlaces σ (H-H) y π. La cantidad de calor desprendida al hidrogenar un mol de un compuesto se llama calor de hidrogenación; es simplemente el ΔH de la reacción.
El Calor de Hidrogenación de casi todo alqueno se aproxima bastante a un valor de 30 kcal por cada doble enlace del compuesto, lo que puede observarse en la tabla siguiente:
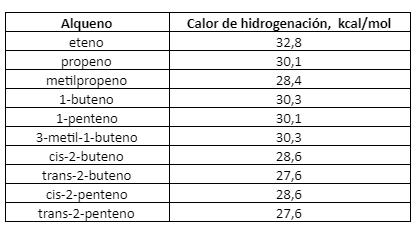
Calor de hidrogenación y estabilidad de los alquenos
A menudo, los calores de hidrogenación pueden brindarnos información valiosa acerca de las estabilidades relativas de compuestos no saturados.
En los 2-butenos isómeros, por ejemplo, el cis tiene un calor de hidrogenación de 28.6 kcal, y el trans, de 27.6 kcal. Ambas reacciones consumen un mol de hidrógeno y dan el mismo producto, n-butano. Por lo tanto, si el isómero trans libera 1 kcal menos de energía que el cis, sólo puede significar que contiene 1 kcal menos de energía. En otras palabras, el isómero trans es más estable que el cis en 1 kcal.
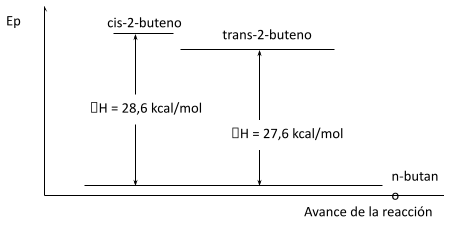
De los alquenos simples disustituidos, el isómero trans generalmente es el más estable; los dos sustituyentes mayores están más separados que en el isómero cis, por lo que hay menos impedimento y menor tensión de Van der Waals.
Los calores de hidrogenación indican que la estabilidad de un alqueno también depende de la ubicación del doble enlace. Son característicos los ejemplos siguientes:
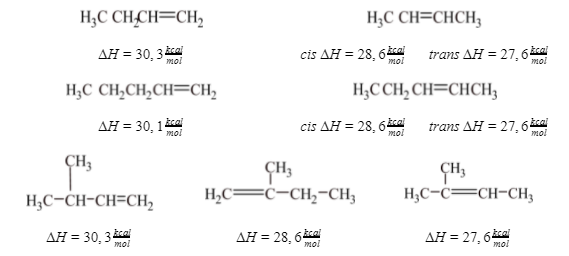
Cada grupo de alquenos isómeros da el mismo alcano. En consecuencia, las diferencias en calores de hidrogenación deben proceder de diferencias en estabilidades. En cada caso, se observa que cuanto mayor es el número de grupos alquilo unidos a los carbonos del doble enlace, menor es el calor de hidrogenación y más estable es el alqueno.

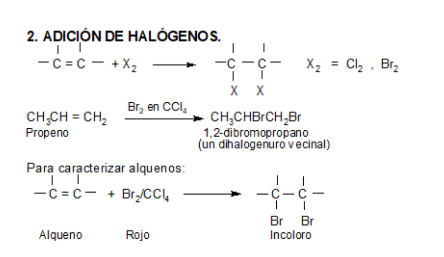
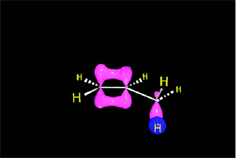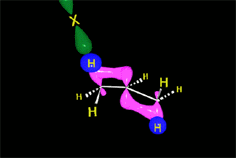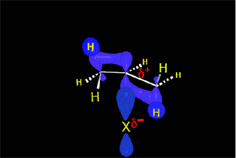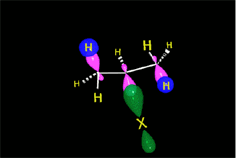
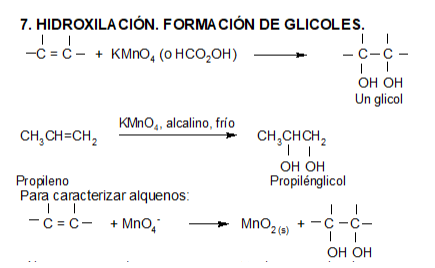
A diferencia de los alcanos, los alquenos reaccionan rápidamente a temperatura ambiente y en ausencia de luz con bromo líquido puro o con una solución de bromo en algún solvente orgánico como el tetracloruro de carbono. El doble enlace se rompe y los átomos de bromo se adicionan a cada uno de los carbonos. El color rojo amarronado característico del bromo se pierde, obteniéndose un líquido incoloro. Por ello, esta es una reacción útil para distinguir alcanos de alquenos. Los productos de estas reacciones son dihaluros vecinales.
Los otros halógenos, excepto el flúor, se comportan en forma similar. (El flúor reacciona con todos los hidrocarburos en forma explosiva dando carbón y fluoruro de hidrógeno)
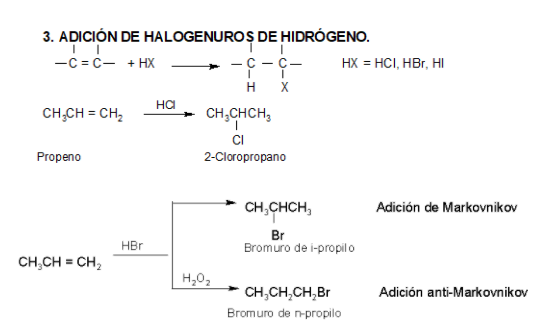
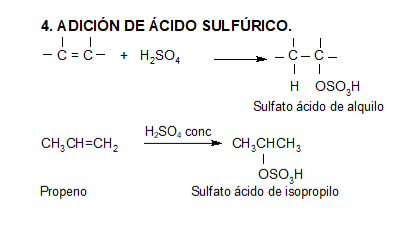
Los ácidos fuertes de Brönsted, tales como HCl, HBr y HI se adicionan rápidamente al doble enlace.
https://aulaabierta.ingenieria.uncuyo.edu.ar/mod/resource/view.php?id=61727
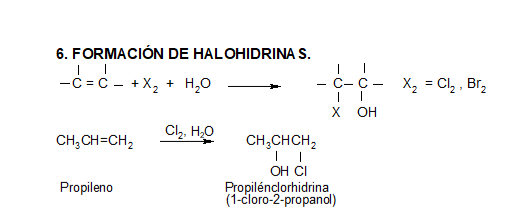
En el caso del ácido hipobromoso o hipocloroso (XOH), que son ácidos débiles de Brönsted, no reaccionan como dadores de protones. Ya que el oxígeno es más electronegativo que el cloro o el bromo, el electrófilo será el catión del halógeno (X+). La especie nucleofílica que se une al carbocatión intermedio es por lo tanto el ion hidróxido. El producto es denominado halohidrina.
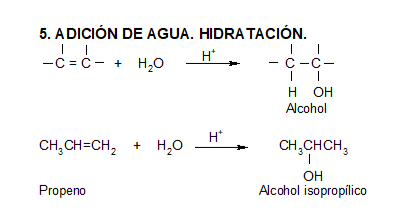
Los ácidos débiles como el agua normalmente no se adicionan a los alquenos. Sin embargo, una pequeña cantidad de ácido fuerte (ej.: SO4H2) sirve para catalizar la adición de agua, obteniéndose de esta manera alcoholes a partir de alquenos.
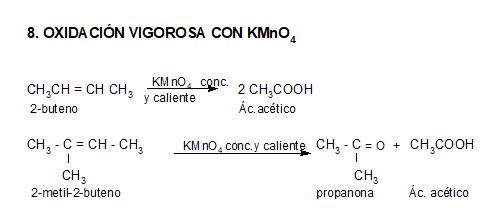
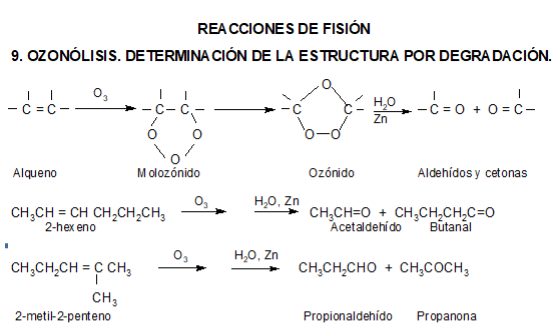
Reacciones de oxidación
4. ALQUINOS
Los alquinos presentan una triple ligadura como grupo funcional. También se los conoce como hidrocarburos acetilénicos, si bien acetileno es el nombre común del menor de los miembros de esta familia.
Nomenclatura
http://www.qorganica.es/QOT/T5/nomenclatura_alquinos_exported/index.htmlPropiedades físicas
El triple enlace de los alquinos está constituído por el solapamiento frontal de dos híbridos sp (un enlace "sigma") y el solapamiento lateral de cuatro orbitales p sin hibridar (dos enlaces "pi"):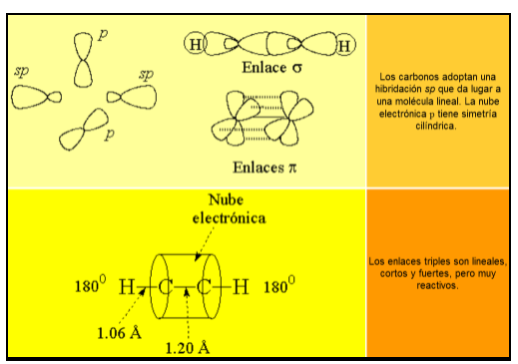
Los alquinos tienen propiedades físicas parecidas a los alcanos y alquenos correspondientes.

MUY IMPORTANTE: El acetileno y los alquinos terminales son relativamente ácidos:
La carga negativa reside en un orbital sp en el anión del acetileno. Cuanto mayor carácter s tiene un orbital híbrido, los electrones allí alojados estarán más cerca y más atraídos por el núcleo, serán más estables, menos básicos y el ácido conjugado será, por ello, más fuerte.
REACCIONES
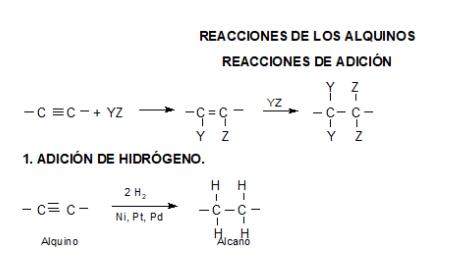
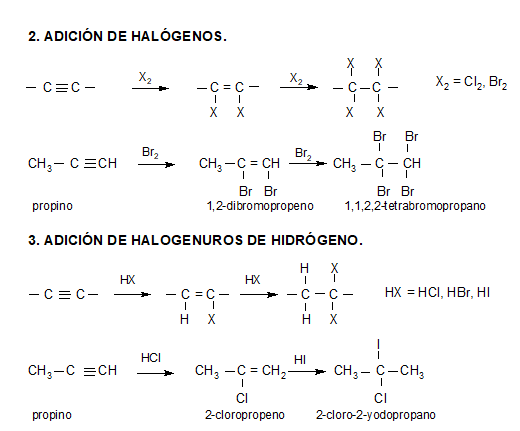
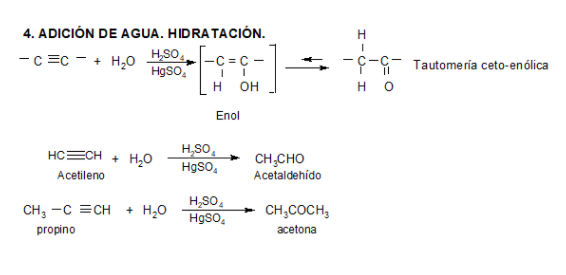
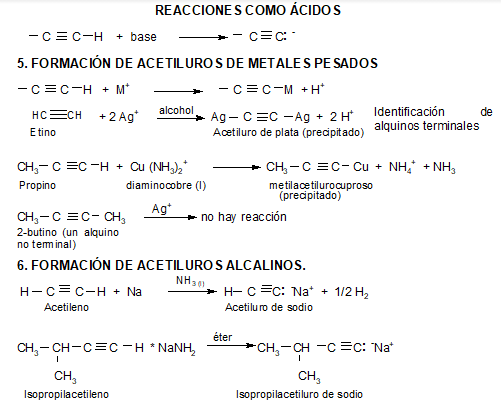
La acidez del acetileno y de los alquinos con el triple enlace en el extremo de la cadena (R-C≡CH) es una propiedad única que diferencia estos hidrocarburos de los alcanos y alquenos. Un carbono con triple enlace es más electronegativo que el carbono con enlace simple o doble. Por lo tanto, un hidrógeno unido a un carbono con triple enlace, como en el acetileno o en otro alquino con triple enlace en el extremo de la cadena, tiene una acidez considerable.
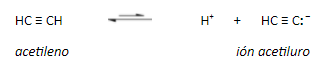
La teoría del enlace de valencia explica este fenómeno basándose en la influencia que tiene la hibridación del átomo de carbono unido a un hidrógeno sobre la acidez: con más carácter s en el orbital híbrido (sp > sp2 > sp3), más cerca del núcleo están los electrones compartidos con el átomo de hidrógeno. Esto hace que, por un lado, aumente la electronegatividad del C, y por ende la polaridad del enlace C-H dejando más expuesto el H. Por otro lado, el anión que se forma al romper el enlace C-H es más estable cuanto más carácter s tiene el orbital híbrido del carbono, porque puede acomodar mejor la carga. Además, el anión formado es una base más débil porque los electrones están menos disponibles al aumentar el carácter s, es decir que su ácido conjugado es más fuerte.


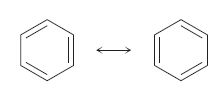
5. HIDROCARBUROS AROMÁTICOS
El término aromático se utiliza por razones históricas para referirse a la clase de compuestos estructuralmente relacionados con el benceno. El benceno es descrito por la teoría de enlace-valencia como un híbrido de resonancia de dos estructuras equivalentes.
El benceno es descrito por la teoría del orbital molecular como una molécula conjugada cíclica y plana con seis electrones pi. De acuerdo con la regla de Hückel, para que una molécula sea aromática debe tener 4n + 2 electrones π.
Los compuestos aromáticos tienen las siguientes características:
-
Los compuestos aromáticos son cíclicos, planos y conjugados.
-
Los compuestos aromáticos son inusualmente estables; por ejemplo, el benceno tiene un calor de hidrogenación 150 kJ/mol menor de lo que podría esperarse para el trieno cíclico.
-
Los compuestos aromáticos reaccionan con los electrófilos para dar productos de sustitución, en los que se retiene la conjugación cíclica, en lugar de productos de adición, en los que se destruye la conjugación.
-
Los compuestos aromáticos tienen 4n + 2 electrones π, los cuales se deslocalizan sobre el anillo.
Los invitamos a adentrarnos al estudio de este tipo de compuestos orgánicos:
UN POQUITO DE HISTORIA…¿Cómo nacieron los hidrocarburos aromáticos?
Analicemos la estructura del benceno
COMPUESTOS MONOSUSTITUIDOS DEL BENCENO
Son aquellos compuestos que resultan de reemplazar un hidrógeno del Benceno por un algún sustituyente.
Estos sustituyentes son grupos funcionales que le confieren propiedades químicas particulares a cada compuesto.
Aunque hay que evitar el uso de nombres comunes, las reglas de la IUPAC permiten conservar algunos de los más difundidos.
A continuación se detallan los compuestos más comunes y sus usos y funciones:
TOLUENO
USOS:
se adiciona a los combustibles (como antidetonante)
disolvente para pinturas, revestimientos, caucho, resinas, diluyente en lacas nitrocelulósicas y en adhesivos.
Precursor en la manufactura de ácido benzoico, benzaldehído y otros compuestos orgánicos.
Producto de partida en la síntesis del TNT (2,4,6-trinitrotolueno), un conocido explosivo.
También se puede utilizar en la fabricación de colorantes.
FENOL
USOS:
Producción de resinas fenólicas, nylon y otras fibras sintéticas.
El fenol es muy utilizado en la industria química, farmacéutica y clínica como un potente fungicida, bactericida, antiséptico y desinfectante,
Producción de agroquímicos, bisfenol A (materia prima para producir resinas epoxi y policarbonatos), en el proceso de fabricación de ácido acetilsalicílico (aspirina) y en preparaciones médicas como enjuagues bucales y pastillas para el dolor de garganta.
ANILINA
USOS:
Se utiliza también para la fabricación de caucho, herbicidas, productos a base de látex, barnices, explosivos, aditivos, pigmentos.
En la sección de medicamentos, esta molécula es la base estructural para la síntesis química del paracetamol.
En la industria textil, la anilina tiene su uso principal como precursor del color índigo, tinte que se utiliza para pintar de azul las telas.
BENZALDEHÍDO
USOS:
Saborizante alimentario comercial (sabor de almendras) o disolvente industrial,
Síntesis de otros compuestos orgánicos, que van desde fármacos hasta aditivos de plásticos.
Intermediario importante para el procesamiento de perfume y compuestos saborizantes, y en la preparación de ciertos colorantes de anilina.
USOS:
Es un conservante utilizado tanto como ácido como en forma de sus sales de sodio, de potasio o de calcio.
También es producto de partida en la producción de ésteres del ácido benzoico que se utilizan en perfumería.
Se usa para condimentar el tabaco, para hacer pastas dentífricas, como germicida en medicina y como intermediario en la fabricación de plastificantes y resinas.
NOMENCLATURA
Si se utiliza como nombre base el de un benceno sustituido (anilina, fenol, tolueno, etc.), el sustituyente que da lugar al nombre base debe ocupar la posición 1.
Propiedades físicas
Las propiedades físicas de los compuestos dependen generalmente del tipo de enlaces que mantienen unidos a sus átomos.
La correlación entre las propiedades físicas y la estructura depende de las interacciones o fuerzas intermoleculares.
FUERZAS DE INTERACCIÓN MOLECULAR
Los hidrocarburos aromáticos están formados principalmente por átomos de C e H.
Las diferencias de electronegatividad de carbono e hidrogeno es tan pequeña que no produce polaridad en estas moléculas. Por tanto, la asociación intermolecular que los caracteriza son las FUERZAS DE DISPERSIÓN DE LONDON
Las propiedades físicas dependen tan solo del peso molecular.
PUNTO DE EBULLCIÓN
Al igual que en los hidrocarburos alifáticos, los puntos de ebullición de estos compuestos aumentan a medida que aumenta el peso molecular; usualmente se produce un aumento entre 20 y 30 °C por cada átomo de carbono que se agrega a la cadena.
PUNTO DE FUSIÓN
Los puntos de fusión aumentan a medida que aumenta el peso molecular.
Los puntos de fusión también dependen de la simetría estructural de las moléculas. Las moléculas mas simétricas tienen mayor punto de fusión que las asimétricas.
Así, entre los bencenos disustituidos, los isómeros para son mas simétricos que los meta y que los orto, presentando mayor punto de fusión. Por otra parte, la introducción de un grupo metilo al benceno, lo hace perder su simetría, bajando su punto de fusión de 5,5ºC (benceno) a -95ºC (metil-benceno).
SOLUBILIDAD
Tal como se señalo anteriormente, las fuerzas de asociación molecular que mantienen a estos compuestos en su estado físico respectivo, son fuerzas dispersión de London
De esto se deduce que estos compuestos son altamente hidrofóbicos y apolares, por lo tanto, insolubles en agua y solubles en solventes apolares como los hidrocarburos alifáticos o aromáticos.
Propiedades químicas
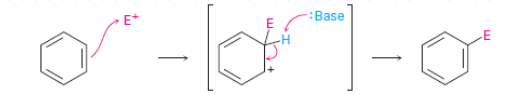
Las características químicas principales de estos hidrocarburos es que reaccionan por la vía de sustituir sus hidrógenos por agentes electrofílicos
Ocurre con la participación de compuestos electrófilos que son especies que atacan los anillos aromáticos, son ávidos por electrones (CH3+, SO3, X+ , NO2+)
4 tipos de reacciones:
SULFONACIÓN
NITRACIÓN
ALQUILACIÓN
HALOGENACIÓN
SULFONACIÓN
La sulfonación utiliza como reactivo trióxido de azufre, el cual es el encargado de sustituir un hidrógeno del anillo bencénico.
Reactivos: Benceno + SO3
Catalizador: H2SO4
Electrófilo: SO3
NITRACIÓN:
La nitración utiliza como reactivo una mezcla de ácido nítrico y sulfúrico. El ácido sulfúrico protona el –OH del ácido nítrico que se elimina en forma de agua generando el catión nitronio,
Reactivos: Benceno + HNO3
Catalizador: H2SO4
Electrófilo: NO2+
ALQUILACIÓN: Friedel-Craft
Reactivos: Benceno + Cloruro de isopropilo
Catalizador: FeCl3/ AlCl3
Electrófilo: (CH3)2CH+
HALOGENACIÓN:
Reactivos: Benceno + Cl2
Catalizador: FeCl3/ AlCl3
Electrófilo: Cl+
En ambas reacciones se requiere la presencia de un ácido de Lewis para lograr la formación del electrófilo. El cual será el encargado de sustituir un H del anillo bencénicoEFECTOS DE LOS GRUPOS SUSTITUYENTES
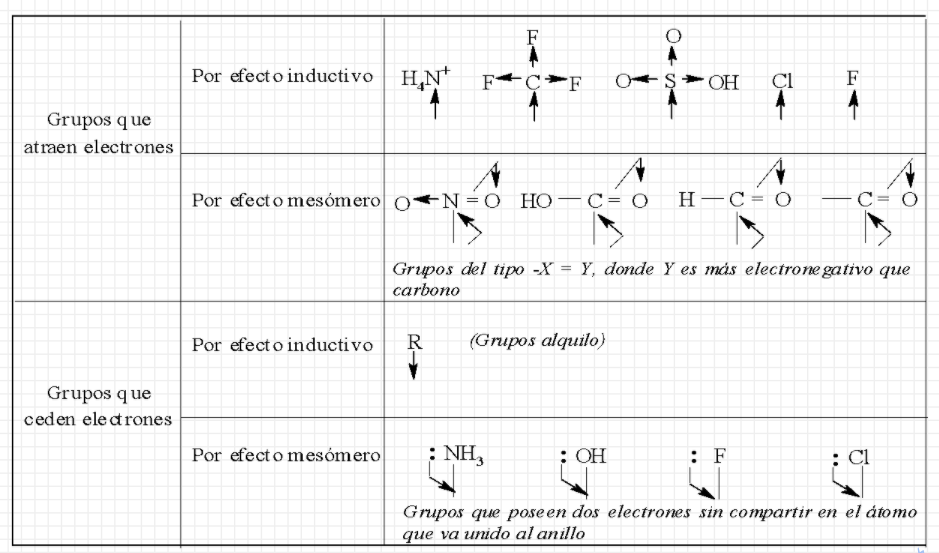
Al sustituyente presente (G) se lo clasifica de acuerdo a cómo influye sobre la reactividad y la orientación:
|
|
|
(favorece la SE en esas posiciones)
(favorece la SE en esa posición) |
Según la reactividad


Según los resultados experimentales se ha concluido que:
Los sustituyentes Activantes son orientadores a orto- y para-
Los sustituyentes Desactivantes son orientadores a meta-
Los Halógenos son desactivantes y orientadores a orto- y para (excepción de las dos reglas anteriores).
Un grupo desactivante, desactiva todas las posiciones, pero desactiva más las posiciones orto y para.
Un grupo activante activa todas las posiciones, pero activa más las posiciones orto y para.
Clasificación de los grupos sustituyentes
REACCIONES REDOX
Reacciones de Oxidación:
El benceno a diferencia de los alquenos no reacciona frente a agentes oxidantes tales como KMnO4, K2Cr2O7, etc.
Reacciones de Reducción:
Algunas reacciones de cadenas laterales
HalogenaciónOxidación
En cadenas laterales con al menos 1 enlace C - H
Síntesis de compuestos aromáticos
Síntesis de ácido p-dodecilbensulfónico a partir de benceno
Estrategia de síntesis
1.- ¿Se puede partir de
o
?
El análisis de los grupos presentes indica que, uno de ellos, es un orientador orto-para: ( CH2)11CH3 y el otro, es un orientador meta: SO3H
Luego, el esquema de la síntesis es
Síntesis de compuestos aromáticos
Estrategia de síntesis
1.- ¿Se puede partir de
La respuesta es no, ya que en cada uno de ellos hay un sustituyente orientador a la posición meta (COOH y NO2)
Como en el producto ambos sustituyentes están en la posición para, por lo menos uno de ellos, inicialmente era un orientador orto-para que después sufrió una transformación química, transformándose en un orientador meta.
El análisis de los grupos presentes indica que, lo más probable es que el grupo carboxilo provenga de la oxidación de un grupo alquilo presente en un anillo que ya tenía incorporado el grupo nitro (inerte a la oxidación).
Luego, el reactivo inicial es el tolueno, que por nitración da p-nitrotolueno
y el esquema de la síntesis es
SUSTITUCIÓN NUCLEOFÍLICA
El clorobenceno, compuesto monosustituido del benceno, tiene la capacidad de sufrir sustitución nucleofílica aromática, para formar fenol. Esto puede observarse en la siguiente reacción general: