Compuestos oxigenados
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curso: | Química Orgánica 2023 |
| Libro: | Compuestos oxigenados |
| Imprimido por: | Cuenta visitante |
| Día: | domingo, 1 de febrero de 2026, 17:25 |
Descripción
Estos compuestos están constituidos por carbono, hidrógeno y oxígeno.
1. Alcoholes
NOMENCLATURA
Los alcoholes se pueden imaginar cómo derivados del agua en los que un hidrógeno ha sido reemplazado por un grupo alquilo. El grupo funcional se denomina hidroxilo.
Se llaman alcoholes primarios los que presentan el grupo funcional
unido a un carbono primario. De manera análoga los alcoholes secundarios tienen
el grupo hidroxilo unido a un carbono secundario y los alcoholes terciarios son
los que lo tienen unidos a un carbono terciario.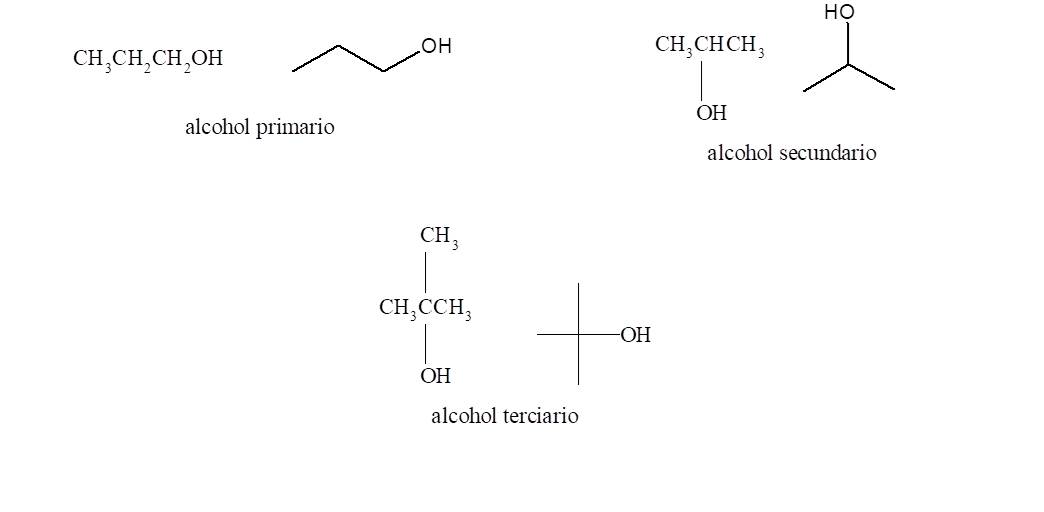
Para nombrarlos se siguen las siguientes reglas:
- Se determina la cadena de átomos de carbono más larga que contiene el grupo funcional y que dará origen al nombre base, cambiando la terminación ano por ol.
- Se numera esa cadena de forma de asignar al grupo funcional el menor número posible, independientemente de los grupos alquilo ramificantes.
- La posición a la que se une el grupo funcional
se indica con un número adelante del nombre y separado del mismo con un guión.
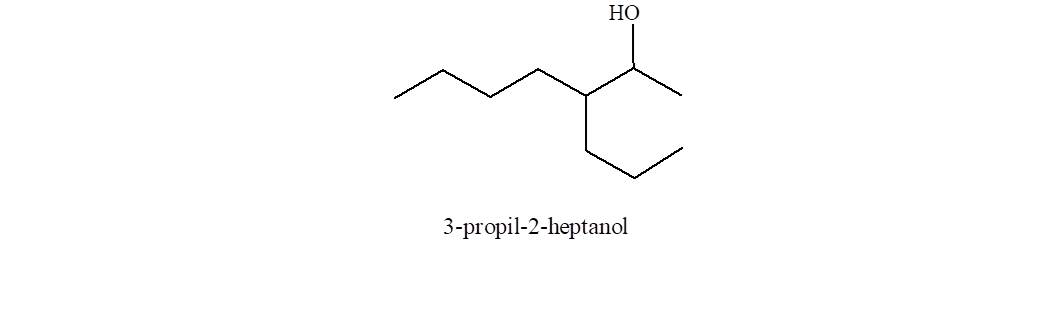
Observe que la cadena más larga es de ocho átomos de carbono, pero la cadena más larga que contiene el grupo funcional es de sólo siete.
Los alcoholes sencillos tienen un sistema de nomenclatura que no responden a las reglas IUPAC pero que está ampliamente difundido.
 PROPIEDADES FÍSICAS
PROPIEDADES FÍSICAS
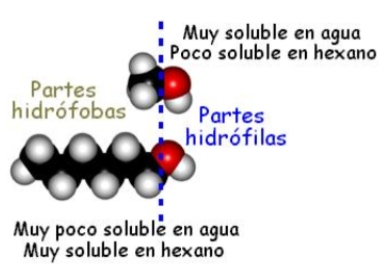
Contienen el grupo −OH muy polar, lo que permite la formación de puentes de hidrógeno.
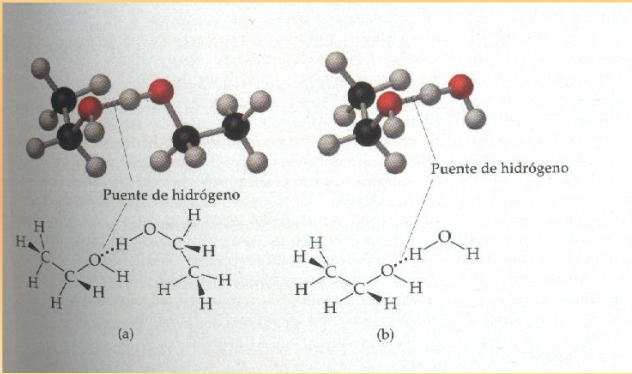
Solubilidad en agua
Disminuye al aumentar el tamaño del grupo alquílico
Los invitamos a visualizar el siguiente video del profesor Ernesto Brunet
PREPARACIÓN DE ALCOHOLES
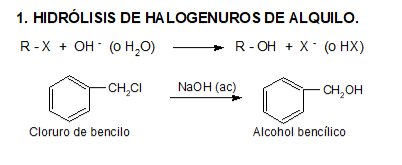
Otras formas de obtención de alcoholes son:
Adición de agua a alquenos
Adición de agua a alquinos
Oxidación de alquenos. Hidroxilación.
(Ver Unidad 3. Reacciones de Alquenos y Alquinos)
REACCIONES
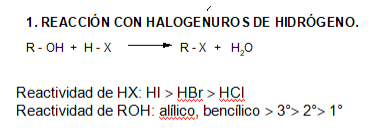
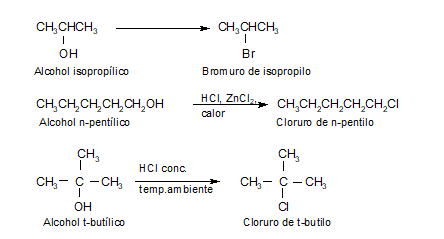
Este es uno de los métodos utilizados para preparar haluros de alquilo, los que también se obtienen a partir de alquenos por adición electrofílica.
El carácter de base de Lewis del alcohol permite la adición del H+ en una primer etapa, generándose un ión oxonio o alcohol protonado (R-OH2+), donde el enlace C-O es más polar que el del alcohol. Esto favorece la ruptura heterolítica de dicho enlace, con formación del ión carbonio.
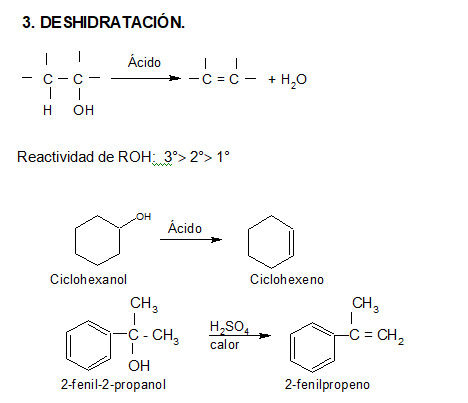
Los alcoholes, al ser calentados en medio ácido, se deshidratan intramolecularmente, formando alquenos. Para esto siguen un mecanismo de eliminación iónica.
ACIDEZ DE ALCOHOLES
Para comprender el tema Acidez y Basicidad les proponemos ver los videos del Profesor Ernesto Brunet.
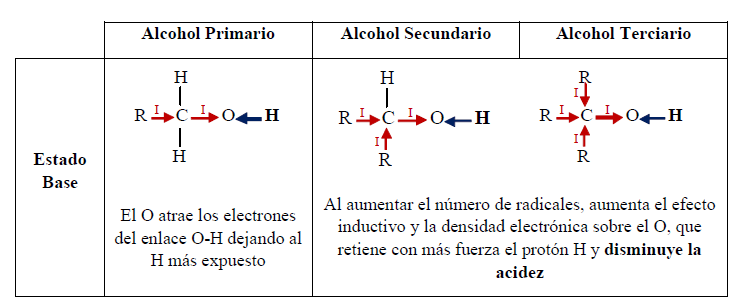
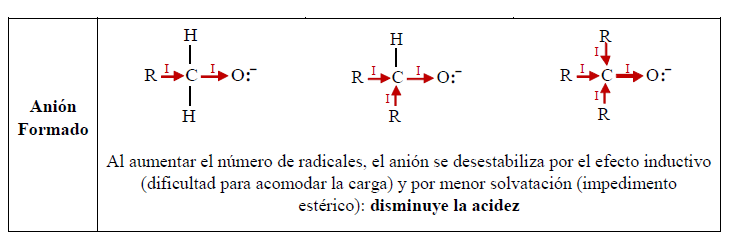
Los alcoholes son sustancias que pueden actuar como ácidos o como bases.
Como ácidos, los alcoholes presentan acidez similar al agua. El hidrógeno está unido al oxígeno (muy electronegativo), y la polaridad del enlace O-H facilita la separación de un protón, mientras que el oxígeno acomoda muy bien la carga negativa de los electrones dejados.
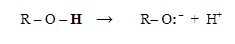
La diferencia entre el alcohol y el agua es el grupo alquilo:
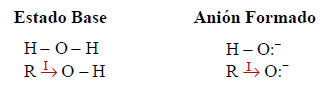
En el agua, al no haber grupo alquilo y por consiguiente efecto inductivo, el enlace O-H es más polar que en el alcohol. Además, el anión del agua es más estable que el del alcohol, en el cual el efecto inductivo aumenta la densidad negativa sobre el oxígeno, haciéndolo menos estable. Por otro lado, la solvatación del anión contribuye a la estabilización del mismo. A mayor tamaño del grupo alquilo, la solvatación se dificulta por el impedimento estérico, lo cual reduce la estabilidad del anión.
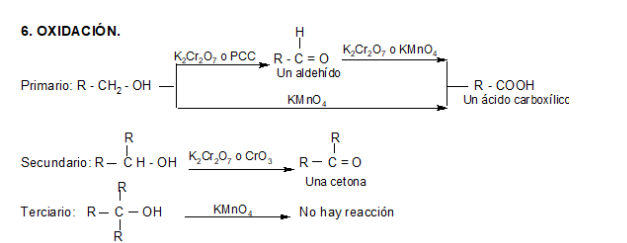
El compuesto que resulte de la oxidación de un alcohol depende del número de hidrógenos unidos al carbono enlazado con el grupo –OH, es decir, depende si se trata de un alcohol primario, secundario o terciario.
Alcoholes primarios
Un alcohol primario tiene dos hidrógenos unidos a carbono (R−CH2OH), de modo que puede perder hidrógeno para dar un aldehído o, incluso, un ácido. En ambos casos, conserva la cadena carbonada intacta.
Alcoholes secundarios
Un alcohol secundario puede perder su único hidrógeno (R2CHOH) para transformarse en una cetona, manteniendo inalterada la cadena carbonada.
Alcoholes terciarios
Un alcohol terciario (R3COH) no tiene hidrógenos unidos al carbono al que va unido el –OH, de manera que no es oxidado con métodos comunes, ya que debería romperse la cadena carbonada.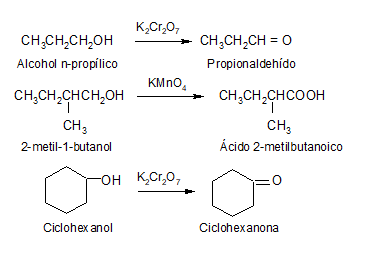
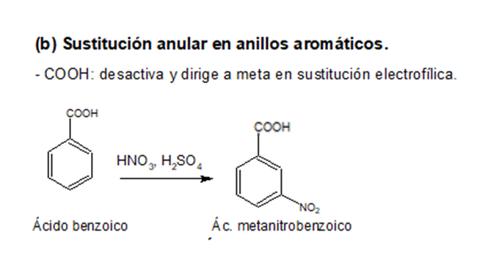
2. Fenoles
NOMENCLATURA
Los fenoles constan de un grupo hidroxilo unido directamente al anillo bencénico.
Los fenoles sustituidos son muy abundantes en la naturaleza.
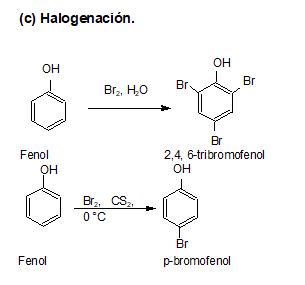
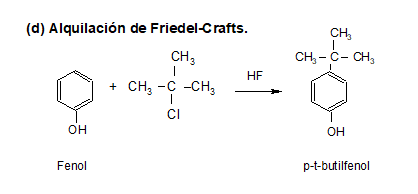
REACCIONES
Los fenoles son compuestos ácidos, siendo más ácidos que los alcoholes y el agua.

Observando las estructuras del alcohol, del fenol y de los respectivos aniones, se deduce:
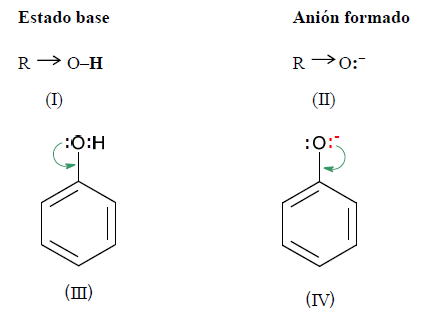
En (I) el efecto inductivo de R aumenta la densidad electrónica sobre el oxígeno, lo que hace que se fortalezca el enlace O - H y, por lo tanto se dificulte su ruptura.
En el ión alcóxido (II), el efecto inductivo de R inestabiliza al anión. Si es menos estable es más difícil de formar
En (III) el efecto mesómero provoca un déficit de densidad electrónica en el oxígeno, lo que significa una mayor atracción por parte del oxígeno de los electrones que comparte con el hidrógeno. Esto facilita la ruptura de dicho enlace.
En el ión fenóxido (IV), hay una gran estabilización por resonancia, es decir, la carga negativa está dispersa en el anión, lo que favorece su estabilización.
A continuación se muestran estructuras contribuyentes del fenol y el anión correspondiente: estructuras V a VII para fenol y VIII al X para el anión.
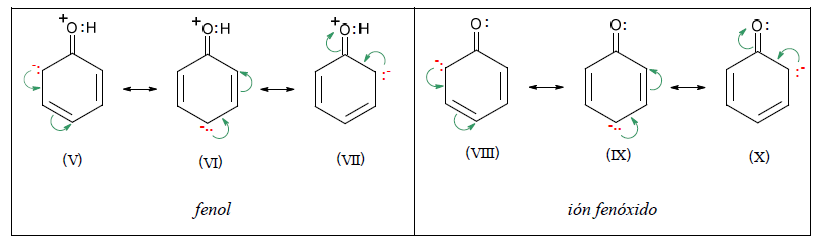
Las estructuras V a VII del fenol son portadoras de una carga positiva y otra negativa, mientras que VIII a X del ión fenóxido sólo llevan una negativa.
Como debe aportarse energía para separar cargas opuestas, las estructuras del fenol deben ser más energéticas y por lo tanto menos estables que las del ión fenóxido. Por otro lado el ión fenóxido, tiene la carga negativa dispersa, como consecuencia del efecto mesómero.
Por lo tanto, el efecto neto de la Resonancia es una estabilización mayor del ión fenóxido que del fenol, por lo que el equilibrio se desplaza en el sentido de la ionización, resultando así Ka mayor que para el alcohol.

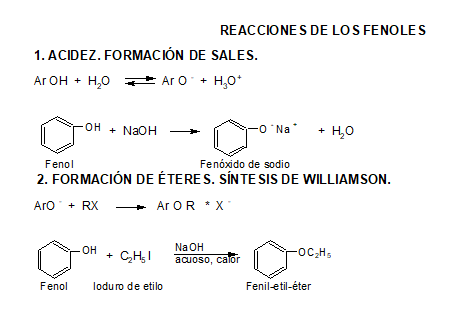
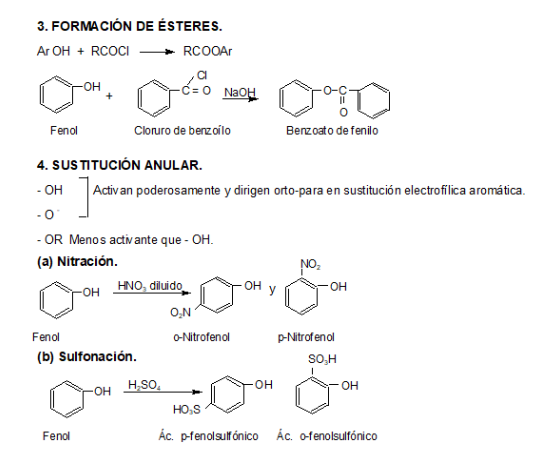
3. Éteres
Los éteres son compuestos orgánicos con un átomo de oxígeno unido a dos grupos que pueden ser alquilo o arilo o vinilo.
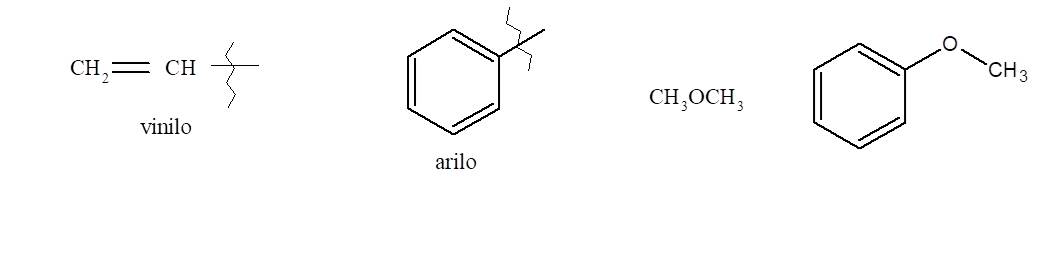 Hay dos formas distintas de nombrar los éteres.
Hay dos formas distintas de nombrar los éteres.
Opción 1: Anteponer la palabra éter seguida de los nombres de los dos grupos alquilo sustituyentes del oxígeno, ordenados alfabéticamente. El primero lleva la terminación il y al segundo se agrega la terminación ico.

Oppción 2: Indicar los dos grupos alquilo, ordenados alfabéticamente, delante de la palabra éter:
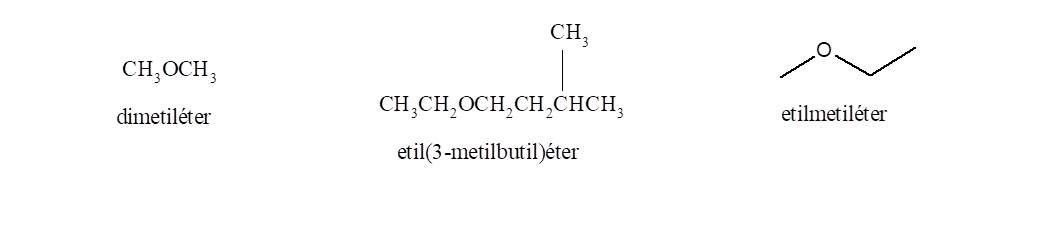
4. Aldehidos y cetonas
Grupo funcional en aldehidos
El grupo carbonilo está formado por un átomo de carbono y un
átomo de oxígeno unidos por un enlace doble.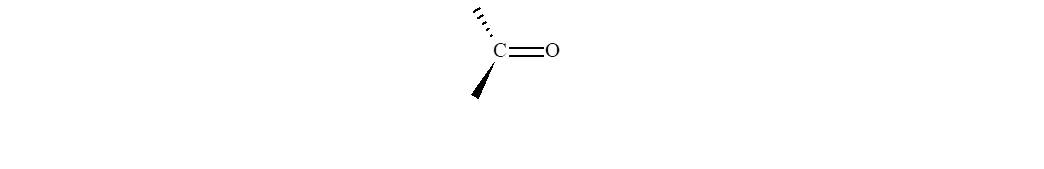 En esta familia de compuestos el carbono carbonílico se une
a otro carbono y un hidrógeno (a excepción del metanal que está unido a dos
hidrógenos).
En esta familia de compuestos el carbono carbonílico se une
a otro carbono y un hidrógeno (a excepción del metanal que está unido a dos
hidrógenos).
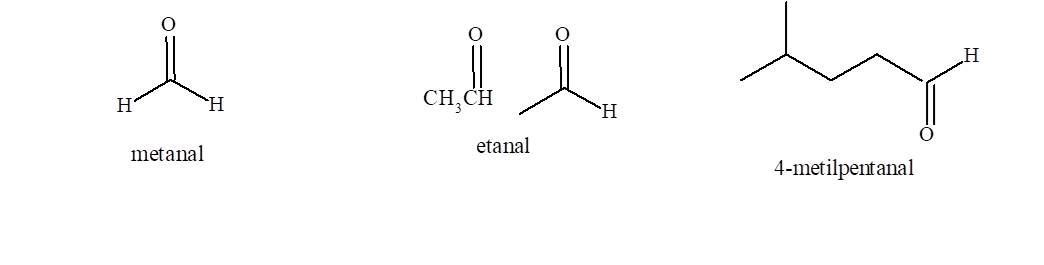
Nomenclatura de aldehidos
- Se elige la cadena más larga que contiene el grupo funcional que dará lugar al nombre base del compuesto.
- Se cambia la terminación o del alcano de igual número de átomos de carbono por la terminación al.
El carbono del grupo funcional es el C-1 de la cadena:
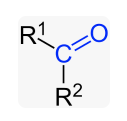
Grupo funcional en cetonas
Esta familia de compuestos se caracteriza por presentar el carbono del grupo funcional (carbono carbonílico) unido a otros dos carbonos.
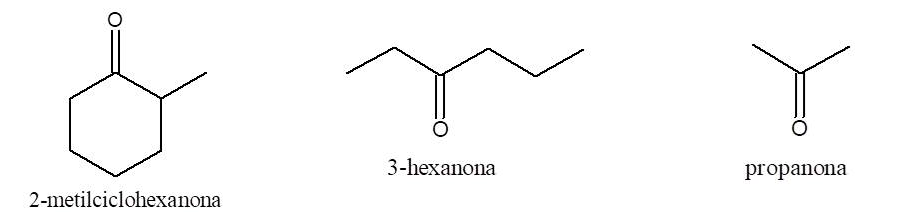
Nomenclatura de cetonas
Para nombrarlos se procede igual que con los aldehídos pero cambiando la terminación o del alcano de igual número de átomos de carbono por ona. Se numera la cadena asignando al carbono carbonílico el menor número posible.
Resumiendo:
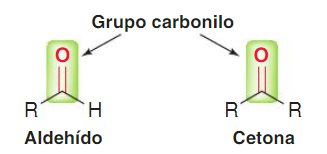
Estructura de aldehídos y cetonas
Los invitamos a visualizar el video del profesor Brunet
Propiedades físicas
Al igual que en alcoholes y fenoles, la mayoría de las propiedades físicas de aldehídos y cetonas se relacionan con la magnitud de las fuerzas intermoleculares y con el tamaño de la molécula.
■ Estado físico: los compuestos de bajo peso molecular como el metanal, son gases, mientras que desde el etanal o acetaldehído, que tiene dos carbonos hasta el dodecanal, de doce carbonos, son líquidos. Compuestos más pesados, se presentan en estado sólido.
■ Punto de ebullición: los puntos de ebullición de aldehídos y cetonas presentan un valor intermedio entre el registrado para éteres y alcoholes, pues la magnitud de la polaridad de los compuestos carbonílicos no es tan grande como la de los alcoholes.
■ Solubilidad: las moléculas pequeñas, de hasta cinco átomos de carbono son solubles en solventes polares, como el agua. A medida que aumenta el tamaño de las moléculas, disminuye la solubilidad de los compuestos. Esto se debe a que la porción polar, es decir, la zona de la molécula que porta el grupo carbonilo se va haciendo cada vez más pequeña en relación con la porción hidrocarbonada, apolar. Como consecuencia de ello, las fuerzas intermoleculares entre solvente y soluto no son suficientemente grandes como para solubilizar moléculas demasiado grandes.
Para estudiar las propiedades físicas les proponemos visualizar el siguiente video:
Ejemplos de aldehidos y cetonas presentes en los alimentos
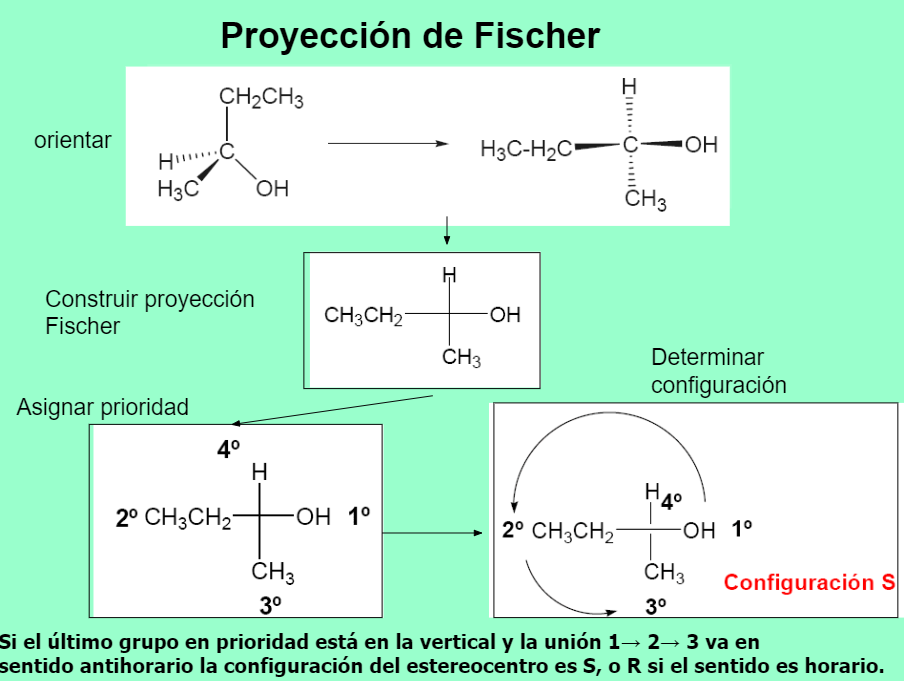
Isomería óptica Nomenclatura RS
NOMENCLATURA DE ENANTIÓMEROS
CONFIGURACIÓN ABSOLUTA R-S
Cahn, Ingold y Prelog establecieron el sistema de nomenclatura R/S para nombrar la configuración absoluta de un estereocentro.Se deja el grupo de prioridad menor (d) hacia atrás y se observa el sentido de giro para ir desde el grupo de mayor prioridad (a) hacia el de menor (c) de los tres que quedan. Si el sentido es el de las agujas del reloj, la configuración es R (rectus). Al contrario, es S (sinister).
Reglas de prioridad
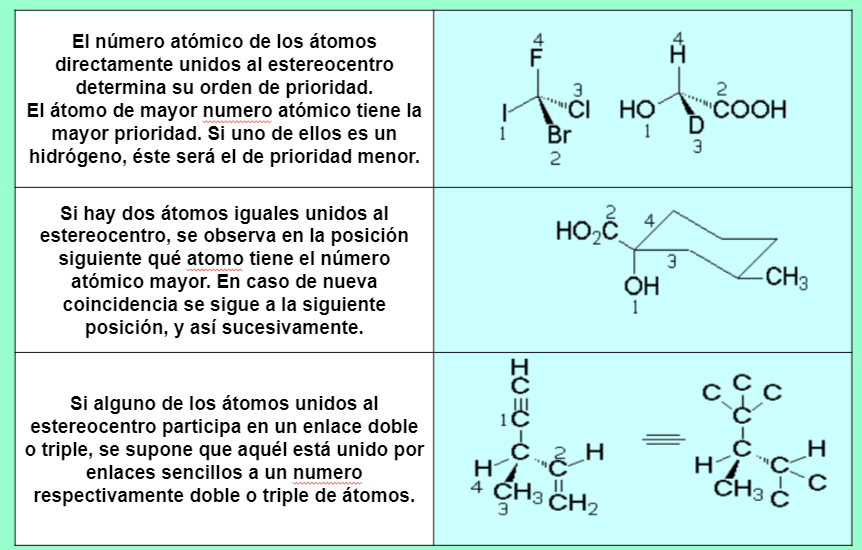
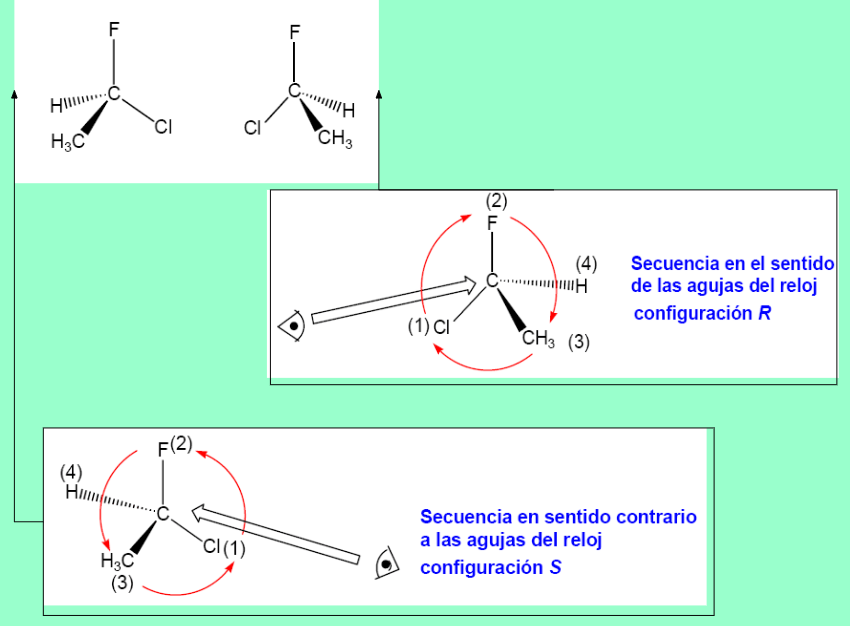
Si el último grupo en prioridad está en la horizontal y la unión 1→ 2→ 3 va en sentido R la configuración del estereocentro es opuesta, o sea, S
Si el último grupo en prioridad está en la horizontal y la unión 1→ 2→ 3 va en sentido S la configuración del estereocentro es opuesta, o sea, R.
CONFIGURACIÓN RELATIVA D y L
La configuración D-L solamente indica que el compuesto tiene la misma configuración que el D ó L gliceraldehído (con el OH hacia la derecha o hacia la izquierda, respectivamente).
PREPARACIÓN DE ALDEHÍDOS Y CETONAS
En
este video se presenta un resumen de los métodos de obtención de aldehídos y
cetonas.
REACCIONES
Les invitamos a ver el video del Profesor Brunet que presenta las reacciones en aldehídos y cetonas.
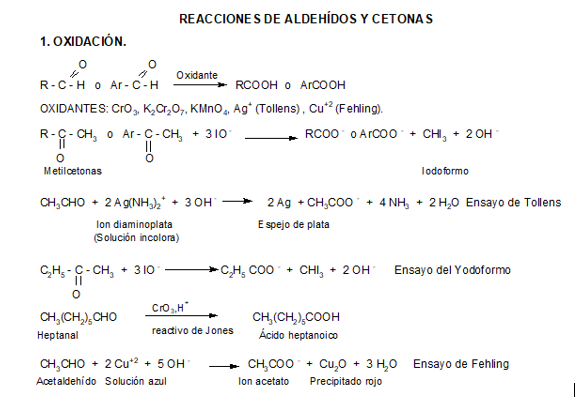
Los aldehídos y cetonas se distinguen fácilmente mediante ensayos químicos, puesto que los aldehídos se oxidan con facilidad a ácidos carboxílicos en condiciones suaves, mientras que las cetonas son relativamente resistentes a la mayoría de los reactivos oxidantes.
Oxidación de aldehídos
Los aldehídos son más fáciles de oxidar que las cetonas, debido principalmente a que los aldehídos pueden pasar a ácidos carboxílicos manteniendo intacta la cadena carbonada.
Para estos compuestos pueden usarse agentes de oxidación muy suaves dándonos así un ensayo altamente selectivo de este grupo funcional. Dos de estos reactivos son el reactivo de Tollens y el reactivo de Fehling.
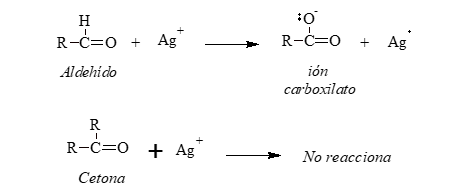
Reactivo de Tollens
El reactivo de Tollens está constituido por:
-Nitrato de plata: provee los cationes plata que oxidan al aldehído.
-Hidróxido de amonio: da el medio básico necesario para que ocurra la reacción.
Aunque el ión plata (Ag+) es un agente oxidante muy débil oxidará a los aldehídos a iones carboxilato. Al hacerlo, el catión plata se reduce a plata metálica. Si la velocidad de la reacción es lenta y las paredes del recipiente están limpias, la plata metálica se deposita sobre las paredes del tubo de ensayo en forma de un espejo; en caso contrario, se deposita como un precipitado gris o negro.
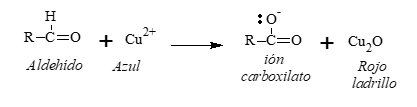
Reactivo de Fehling
El reactivo de Fehling contiene:
- Sulfato cúprico: provee los iones cúpricos (Cu++) que oxidan al aldehído.
- Hidróxido de sodio: da el medio básico.
- Tartrato de sodio y potasio: acompleja a los iones cúpricos y los mantiene en solución.
La oxidación con Reactivo de Fehling presenta un cambio característico de color, desde el azul del complejo cúprico hasta un pardo rojizo del precipitado (óxido cuproso).
Oxidación de cetonas
En el caso de las cetonas, para que ocurra la oxidación se debe romper la cadena carbonada, por lo que la oxidación sólo sucede en condiciones enérgicas.
Si les gustan los videos, les compartimos uno sobre reactivos de Fehling y Tollens de Egg Educación
Reacciones de adición
Los aldehídos y cetonas sufren con facilidad reacciones de adición nucleofílica al doble enlace carbono-oxígeno del grupo carbonilo, debido a las características estructurales del mismo.
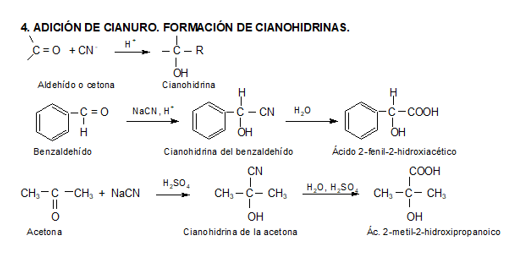
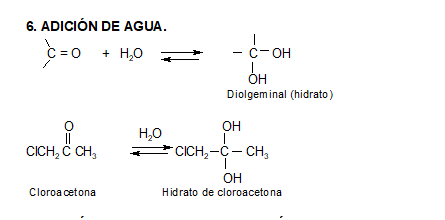
Los aldehídos y cetonas reaccionan con el agua para dar 1,1 dioles.
Estas reacciones son muy lentas si la solución es neutra, pero se acelera notablemente si pequeñas cantidades de ácido o base es agregada.
En general los productos de las reacciones de hidratación no son aislables, ya que el equilibrio se encuentra fuertemente desplazado en dirección del compuesto carbonílico (observar que son dos grupos oxhidrilo, con alta densidad electrónica, unidos a un mismo carbono). No obstante, cuando el grupo carbonilo está unido a grupos aceptores fuertes (ej.: -CCl3), el carbonilo se hace menos estable (posee mayor δ+), y la forma hidratada puede predominar en el equilibrio.
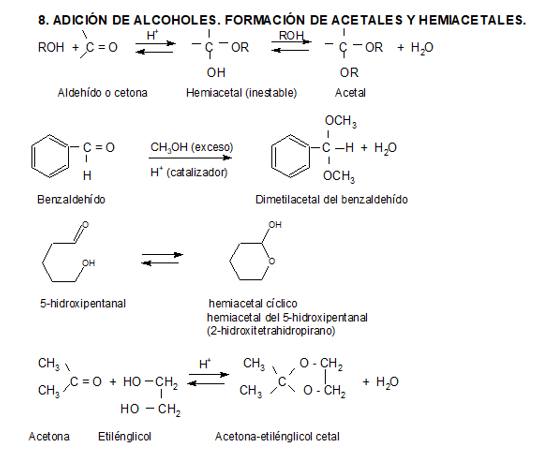
Los alcoholes son nucleófilos debido a los pares libres de electrones en el átomo de oxígeno; pero son nucleófilos relativamente débiles y requieren de una catálisis ácida para reaccionar.
Todos los pasos en esta reacción son reversibles, y es posible controlar el sentido de la misma añadiendo un exceso de uno de los reaccionantes o removiendo uno de los productos a medida que se va formando. Así, para que una cetona (o aldehído) se pueda transformar en un cetal (o acetal) es necesaria la remoción del agua formada durante la reacción. La mayoría de los hemiacetales de cadena abierta no son lo suficientemente estables como para ser aislados. Pero aldehídos que tienen grupos hidroxilos y cuatro a cinco átomos de carbono aparte del grupo carbonilo, pueden formar hemiacetales cíclicos estables por adición nucleofílica intramolecular, lo que veremos detalladamente al estudiar hidratos de carbono.
Propiedades ácido-base de aldehídos y cetonas. Enolización
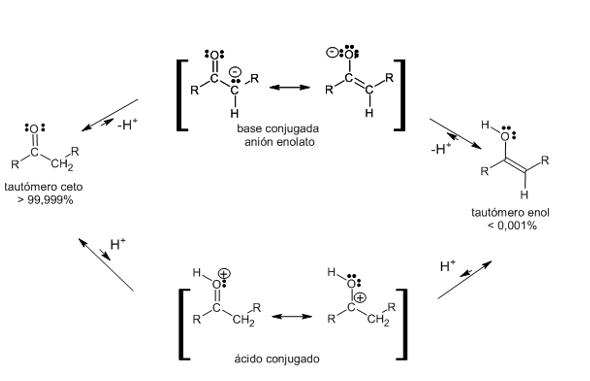
- Una característica de los compuestos de carbonilo (aldehídos y cetonas) es la marcada acidez de los hidrógenos en los carbonos adyacentes al grupo carbonilo, debido a la polaridad del enlace C-H, por el efecto inductivo generado por dicho grupo. Estos hidrógenos se denominan por lo general hidrógenos a y el carbono al que están unidos es el carbono a.
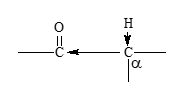
- En un compuesto carbonílico, al romperse ese enlace C-H, se separa un protón y el anión que se produce está estabilizado por resonancia.
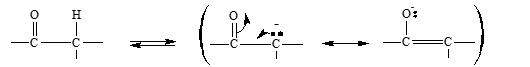
Aquí se ve que es posible escribir dos estructuras de resonancia para el anión. En la primera estructura, la carga negativa está sobre el carbono y en la segunda está sobre el oxígeno. El híbrido puede representarse en la siguiente forma:
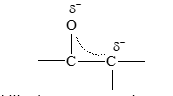
- Cuando este anión, estabilizado por resonancia, acepta el protón puede hacerlo de la siguiente forma:
o Puede adicionar el protón en el carbono, formando el compuesto carbonilo original.
o Puede aceptar el protón en el oxígeno para formar un enol.
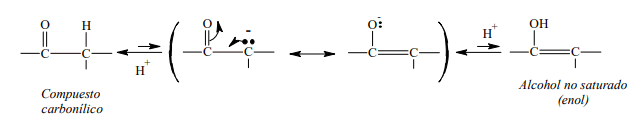
Este equilibrio está muy desplazado hacia la forma carbonílica (izquierda), debido a que en el anión es más probable que sea el carbono el que capte el protón, ya que este elemento es mejor dador de electrones (menos electronegativo) que el oxígeno.
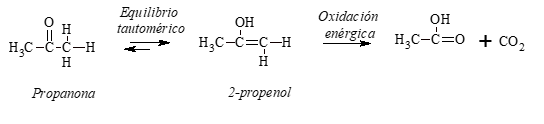
Este equilibrio tautomérico explica la oxidación de las cetonas, ya que el alcohol no saturado es el que sufre la oxidación en el doble enlace carbono-carbono, obteniéndose generalmente mezclas de ácidos carboxílicos (ver oxidación de alquenos) y, en algunos casos, bióxido de carbono.
Ejemplo:
5. Ácidos carboxílicos
El grupo funcional que caracteriza a los ácidos carboxílicos
surge de unir un grupo hidroxilo a un grupo carbonilo. Para nombrarlo se cambia
la terminación o, del alcano que dará
lugar al nombre base, por oico.
Además se antepone la palabra ácido. El carbono del carboxilo es el C-1 de la
cadena.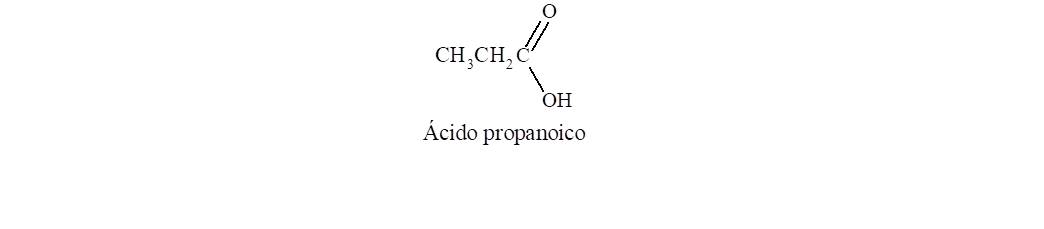
Propiedades físicas
Propiedades ácido base
Ácidos carboxílicos de interés en la naturaleza
REACCIONES


Les presentamos el video del Profesor Brunet que describe métodos industriales y de laboratorio para preparar ácidos carboxílicos.
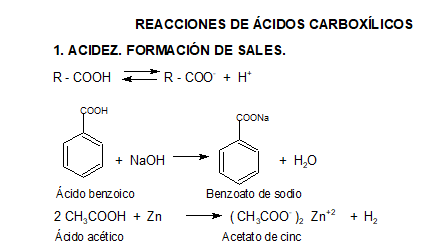
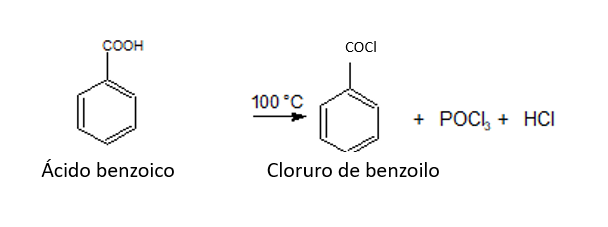
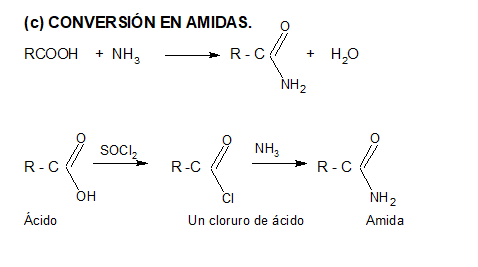
2. CONVERSIÓN EN DERIVADOS FUNCIONALES
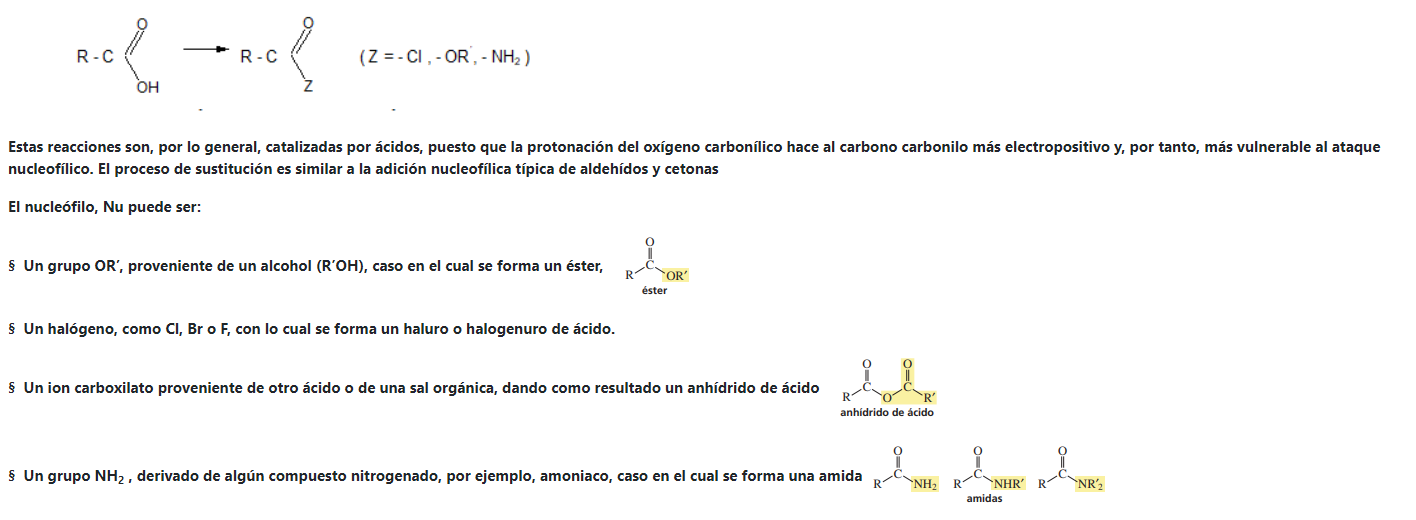
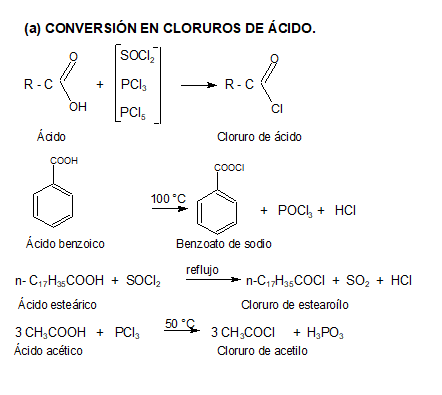
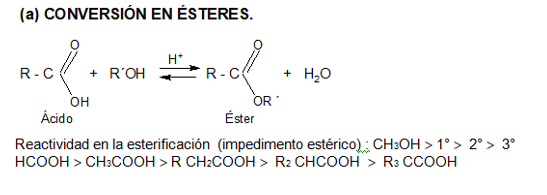
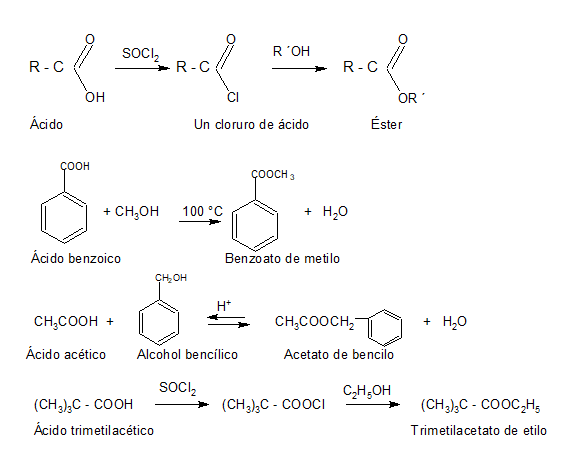
Les presentamos el video del profesor Llorens donde explica reacciones de esterificación: Muestra algunos ésteres, cómo se producen a partir de ácidos carboxílicos y como ejemplo un polímero
Sintesis
de ésteres en el laboratorio. Fragancia
a banana. Acetato de isoamilo
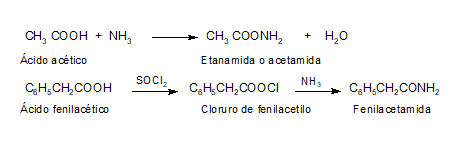
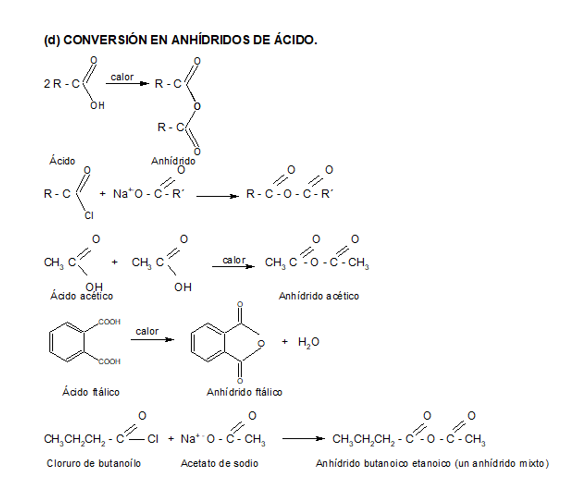
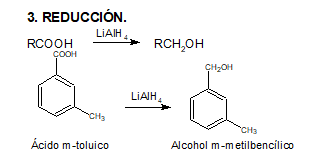
En este video el profesor Brunet nos explica la reducción de ácidos carboxílicos