Aminoácidos y proteínas
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curso: | Química Orgánica 2023 |
| Libro: | Aminoácidos y proteínas |
| Imprimido por: | Cuenta visitante |
| Día: | domingo, 1 de febrero de 2026, 17:25 |
1. Aminoácidos
1.1.Definición. Estructura.
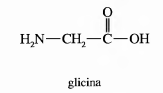
Los aminoácidos son los productos finales de la hidrólisis de las proteínas. Son estructuras que contienen uno o más grupos amino (-NH2) y uno o más grupos carboxilo (-COOH).
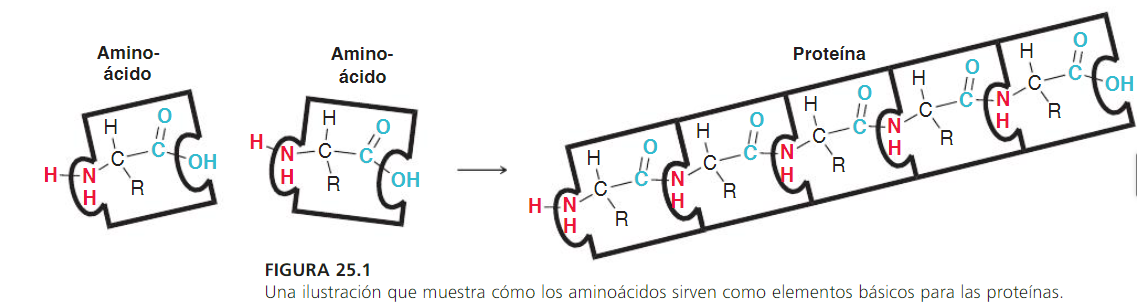
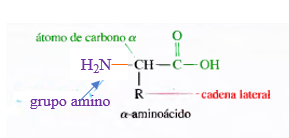
En general, podemos representar un aminoácido como sigue:
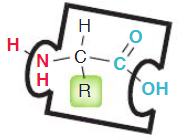
- El grupo -R puede ser de distinta naturaleza química (ej.: un grupo fenólico, un grupo bencénico, un grupo heterocíclico, etc.).
- El grupo amino de los aminoácidos se ubica en el Cα , que es el carbono adyacente al grupo carboxilo. Sólo en dos aminoácidos, prolina e hidroxiprolina, esto no se cumple.
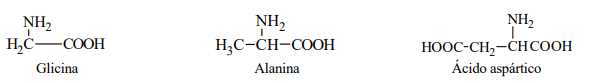
1.2.Aminoácidos naturales y esenciales
Existen 26 aminoácidos naturales, los cuales han sido encontrados en las proteinas, de los cuales diez se
denominan aminoácidos esenciales, no porque sean los únicos necesarios para el funcionamiento de la especie,
sino porque se hace indispensable ingerirlos a través de la dieta porque nuestras células no pueden sintetizarlos. El
resto de los aminoácidos pueden ser sintetizados en nuestras células a partir de compuestos sencillos que
contengan carbono, oxígeno, hidrógeno y nitrógeno.
Las proteínas que contienen los 10 aminoácidos esenciales se denominan proteínas completas. Estas se encuentran en el pescado, la carne, la leche y los huevos. Las que son deficientes en uno o más aminoácidos esenciales, se denominan proteínas incompletas. La ingesta inadecuada de los aminoácidos esenciales puede ocasionar enfermedades, las cuales pueden ser evitadas con una nutrición adecuada.
1.3.Configuración de los aminoácidos
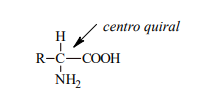
En todos los α-aminoácidos, excepto la glicina, el Cα es centro quiral, lo cual implica que todo aminoácido es
ópticamente activo.
 No es quiral
No es quiral
Los estudios estereoquímicos de estos aminoácidos naturales han demostrado que todos tienen la misma
configuración en el carbono Cα que el L-(-) gliceraldehido.
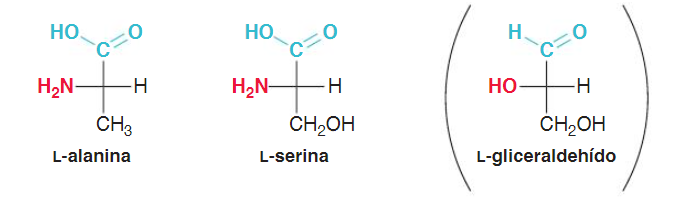
Por analogía con la nomenclatura ordinaria de los carbohidratos se suele decir que pertenecen a la familia L, pero en el caso de los α-aminoácidos, el centro quiral de menor orden es el que determina la familia, mientras que en el caso de los carbohidratos es el centro quiral de mayor orden el que determina la familia.
1.4.Propiedades físicas y químicas
- Son sólidos cristalinos no volátiles.
- Son insolubles en solventes no polares (ej.: benceno, éter, etc.), mientras que son apreciablemente solubles en agua.
- Tienen elevado momento dipolar.
- Como los aminoácidos contienen potencialmente grupos amino y carboxilo libres, son electrolitos anfóteros. El aminoácido sólido es una sal interna o ion dipolar o switerión.
El aminoácido sólido es una sal interna o ion dipolar o switerión.
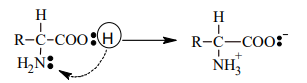
Observar que el H+
del grupo carboxilo (carácter ácido) es captado por el grupo amino (carácter básico). En
solución acuosa se establece un equilibrio:
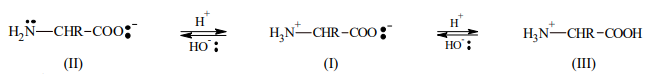
- El aminoácido sólido es una sal interna I (ión dipolar o switerión).
- Cuando la solución es alcalina, hay más aniones II que cationes III (equilibrio desplazado hacia la izquierda).
- En soluciones ácidas, en cambio, se encuentran más cationes III (equilibrio desplazado hacia la derecha).
Por lo tanto, cuando una solución de aminoácido se coloca en un campo eléctrico, la migración del mismo hacia uno u otro electrodo dependerá del pH de la solución.
- En solución alcalina la migración se producirá hacia el ánodo (el aminoácido está como anión: II).
- En solución ácida habrá migración neta del aminoácido hacia el cátodo (el aminoácido está como catión: III).
- Si II y III se equilibran exactamente, no hay migración neta, ya que cualquier movimiento de la molécula como ión positivo hacia el cátodo, será anulado por un movimiento igual y contrario de iones negativos hacia el ánodo.

1.5.Clasificación de los aminoácidos
De acuerdo a que el número de grupos básicos sea igual, mayor o menor que el de grupos acídicos, los aminoácidos pueden ser:
* neutros
* básicos
* ácidos
Ejemplos:
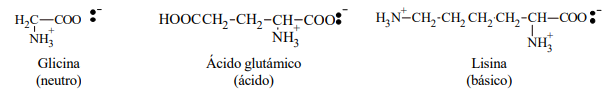
2. Proteínas
Un péptido es la unión de varios aminoácidos por medio de enlaces peptídicos.
Según sea el número de las unidades de aminoácidos por molécula, se los conoce como dipétidos, tripéptidos, etc, hasta llegar a los polipéptidos.
Convencionalmente, se consideran como polipéptidos los que tienen pesos moleculares de hasta 10000.
Proteínas son los polipéptidos cuyos pesos moleculares son superiores a 10000.
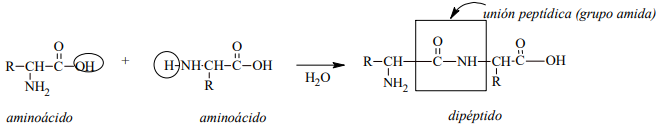
Unión peptídica
La unión peptídica es una unión de tipo amida entre el grupo carboxilo de un aminoácido y el grupo α-amino de
otro aminoácido, con pérdida de una molécula de agua.
Funciones de las proteínas. Clasificación
Estructura de las proteínas
La estructura de las proteínas es una determinada organización de sus elementos constitutivos, los aminoácidos. Podemos considerar a la estructura de las proteínas en varios niveles: primaria, secundaria, terciaria y cuaternaria.
La estructura primaria es la secuencia particular de aminoácidos unidos entre sí por enlaces peptídicos. Esta estructura, característica de cada proteina, tiene relación directa con su actividad fisiológica.
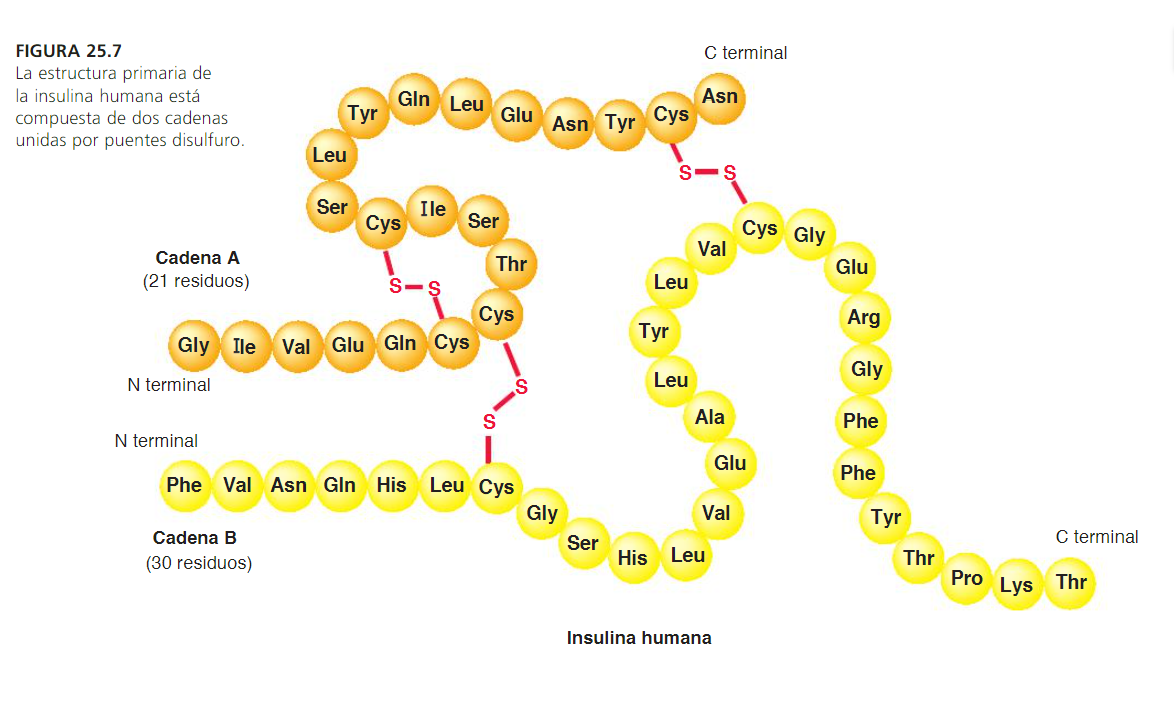
La estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van siendo enlazados durante la síntesis de proteínas adquieren una disposición espacial estable (ej.: helicoidal).
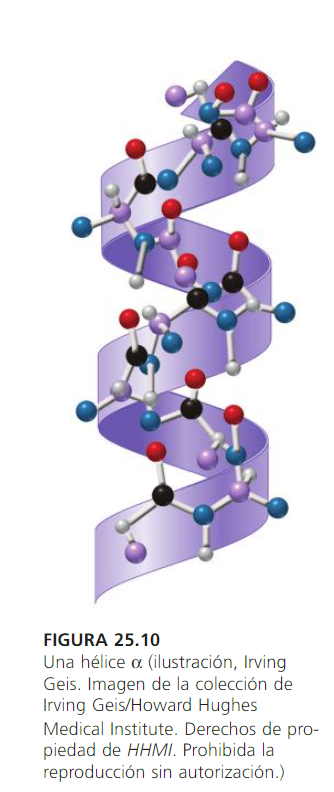
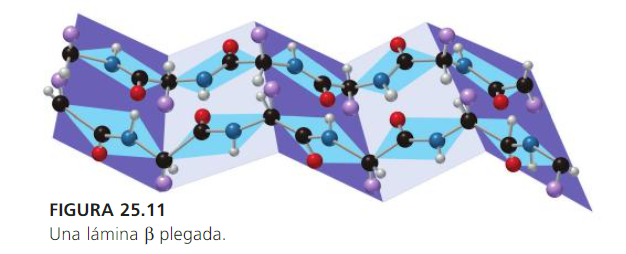
La estructura terciaria informa sobre la disposición de la estructura secundaria de un polipéptido al plegarse sobre sí misma originando una conformación globular, que es la que facilita la solubilidad en agua y así realizar funciones de transporte, enzimáticas, hormonales, etc. Esta conformación globular se mantiene estable gracias a la existencia de enlaces entre los grupos unidos a las cadenas de polipéptidos (ej.: puente disulfuro –S-S- , puentes hidrógeno).
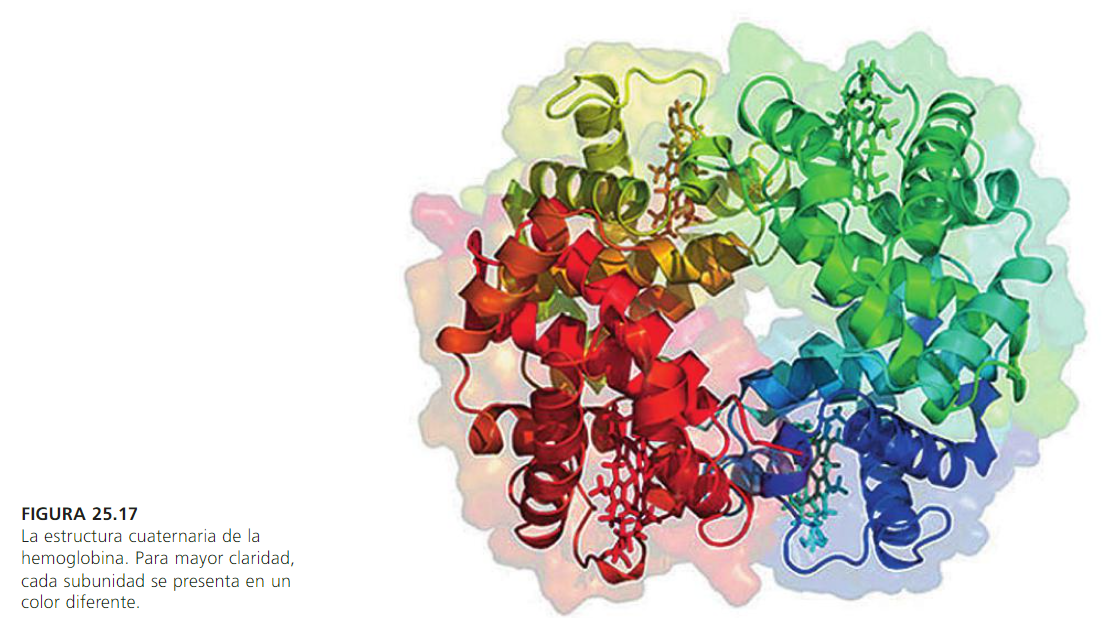
 La estructura cuaternaria es más compleja. Se describe como muchas subunidades, no siempre idénticas, que se
reunen para formar complejos más grandes. No todas las proteínas poseen esta estructura. Informa de la unión,
mediante enlaces débiles no covalentes de varias cadenas polipeptídicas con estructura terciaria, para formar un
complejo proteico.
La estructura cuaternaria es más compleja. Se describe como muchas subunidades, no siempre idénticas, que se
reunen para formar complejos más grandes. No todas las proteínas poseen esta estructura. Informa de la unión,
mediante enlaces débiles no covalentes de varias cadenas polipeptídicas con estructura terciaria, para formar un
complejo proteico.
Desnaturalización de las proteínas