Repasemos algunos conceptos importantes antes de formular...
| Site: | Aula Abierta - Facultad de Ingeniería |
| Course: | Química General e Inorgánica (Ind. y Pet.) 2024 |
| Book: | Repasemos algunos conceptos importantes antes de formular... |
| Printed by: | Invitado |
| Date: | Sunday, 1 February 2026, 2:30 PM |
1. Elementos químicos
ELEMENTOS QUÍMICOS
Constitución de la materia. Conceptos importantes:
Por medio de especulaciones filosóficas los antiguos griegos llegaron a la idea de que la materia está formada por partículas muy pequeñas imposibles de dividir a las que denominaron átomos (significa indivisible). Posteriormente y a través de la experimentación los científicos arribaron a la conclusión de que toda la materia está formada realmente por átomos.
Átomo es la menor porción de materia capaz de combinarse para formar moléculas.
Actualmente se sabe que sí se puede dividir en partículas más pequeñas, llamadas subatómicas, entre las cuales las más importantes son los protones, neutrones y electrones.
Los átomos rara vez se encuentran libres en la naturaleza, sino que se combinan para formar partículas más estables, denominadas moléculas.
Molécula es la menor partícula de una sustancia, formada por átomos combinados en proporción definida y constante, que puede existir libre y presenta todas las propiedades de dicha sustancia. Por ejemplo, el agua es una molécula formada por dos átomos de hidrógeno y
uno de oxígeno.
Representación de las moléculas:
Las moléculas se representan en forma abreviada por medio de las fórmulas químicas. Las sustancias pueden ser simples o compuestas.
Sustancias simples: son las formadas por un mismo tipo de átomos. El número de átomos que constituyen la molécula de las sustancias simples se denomina atomicidad. Algunas sustancias como los gases nobles (He, Ne, Ar, etc.) o los metales (Na, K, Ca, mg, etc.) tienen moléculas constituídas por un solo átomo y se denominan monoatómicas. Algunos átomos como los de fluor (F), cloro (Cl), bromo (Br), iodo (I), oxígeno (O), hidrógeno (H) y nitrógeno (N) no pueden existir solos, así que se unen de a dos formando moléculas denominadas diatómicas y se representan como F2, Cl2, Br2, I2, O2, H2 y N2. El símbolo representa un átomo y el número (2 en estos casos) escrito a su derecha y abajo indica la cantidad de átomos que forman la molécula. Existen también moléculas que provienen de la unión de varios átomos iguales (tres o más) y se denominan poliatómicas. Por ejemplo el P4 (fósforo blanco), O3 (ozono).
Sustancias compuestas: están formadas por átomos distintos. Ejemplo: el dióxido de carbono se representa a través de la molécula CO2, formada por un átomo de carbono y dos de oxígeno.
Para indicar dos o más moléculas se coloca delante de la fórmula el número correspondiente que se denomina coeficiente. Ejemplo: 2 H2O significa dos moléculas de agua; 3 O2 significa tres moléculas de oxígeno.
Elementos y sus símbolos. Concepto
Los elementos son las unidades químicas fundamentales que forman las sustancias simples y compuestas. Son los distintos tipos de átomos.
En la actualidad se han identificado 119 elementos de los cuales aproximadamente 90 se encuentran en la naturaleza y los restantes son artificiales, es decir, obtenidos por el hombre en el laboratorio a través de procesos nucleares.
Los nombres de los elementos provienen del griego o derivan del latín y hacen referencia a alguna propiedad importante del elemento como por ejemplo barys (bario) que significa pesado. Los más recientemente descubiertos se nombran teniendo en cuenta el lugar de descubrimiento como el germanio por Germania (Alemania), o en homenaje a destacados investigadores como el einstenio por Einstein.
Símbolos químicos
Los elementos se representan por medio de símbolos de una o dos letras. Por ejemplo C es el símbolo para el carbono, Ca para el calcio, Cu para el cobre, Co para el cobalto, etc. La primera letra siempre se escribe en mayúscula y la segunda letra se escribe en minúscula.
Los símbolos de algunos elementos derivan del nombre griego o latino por ejemplo Fe de ferrum (hierro) o Na de natrium (sodio).
Clasificación y propiedades de los elementos
Los elementos, de acuerdo a sus propiedades se pueden clasificar en tres grandes grupos:
- Metales.
- No metales.
- Gases inertes.
Ubicación de los elementos en la Tabla Periódica
El nombre, símbolo e información relevante de todos los elementos puede encontrarse en la Tabla Periódica, en la cual se puede observar la distribución de los elementos de acuerdo a la clasificación mencionada.
2. Número atómico y número másico
NÚMERO ATÓMICO Y NÚMERO MÁSICO
Cuando hablamos de elementos estamos hablando de átomos.
Internamente los átomos están formados por partículas subatómicas, las más importantes son tres:
- Protones: partículas cargadas positivamente, dotadas de masa y que se encuentran en el núcleo del
átomo.
- Neutrones: no poseeen carga eléctrica pero si presentan masa y también se encuentran en el
núcleo.
- Electrones: partículas con carga negativa con una masa que se considera despreciable y se
encuentran girando al rededor del núcleo.
Como el átomo en su conjunto es eléctricamente neutro, el número de protones y de electrones es el
mismo.
Cada átomo está caracterizado por dos números importantes:
- Número atómico.
- Número másico.
Número atómico
Los átomos se diferencian unos de otros por la cantidad de protones presentes en el núcleo. Ese número de
protones se denomina número atómico y se representa con la letra Z.
Como los átomos son eléctricamente neutros, y tienen la misma cantidad de protones y electrones,
entonces:
Número atómico = Z = número de protones = número de electrones
Por ejemplo el nitrógeno que tiene un Z = 7, tiene 7 protones en el núcleo y 7 electrones arededor del
núcleo.
Número atómico = Z = número de protones
Número másico
Se representa con la letra A y está relacionado con la masa del átomo.
Anteriormente vimos que los electrones tienen masa despreciable y por lo tanto se puede considerar que la
masa de un átomo está concentrada en su núcleo y proviene de los protones y neutrones. De esta manera:
Por ejemplo el sodio tiene 11 protones y 12 neutrones en el núcleo, por lo tanto su número másico será
A = 11 + 12 = 23
Resumiendo:
Z = número de protones = número de electrones
A = número de protones + número de neutrones
número de neutrones = A – Z
Representación de los átomos
Para representar el número atómico y másico se debe colocar el símbolo del elemento(X, en este caso) y a la
izquierda como superíndice el número másico (A) y como subíndice el número atómico (Z).
Por ejemplo el potasio que tiene:
A = 39 y Z = 19 (datos que pueden extaerse de la Tabla periódica),
Para indicar el número de partículas subatómicas, diríamos que tiene 19 protones, 19 electrones y 20
neutrones ( A – Z = 39 - 19) y lo simbolizaríamos:
Como en los átomos los protones y neutrones se encuentran ubicados en el núcleo, las partículas que intervienen cuando los átomos se combinan, son los electrones, que se encuentran fuera del núcleo. Según los átomos sean metales o no metales tendrán tendencia a ceder, ganar o compartir electrones dando como resultado distintos tipos de compuestos.
3. Iones
IONES
En la naturaleza es muy difícil encontrar átomos neutros al estado libre.
Los IONES son átomos con carga.
- Si la carga final es positiva, reciben el nombre de CATIONES.
- Si la carga final es negativa, reciben el nombre de ANIONES.
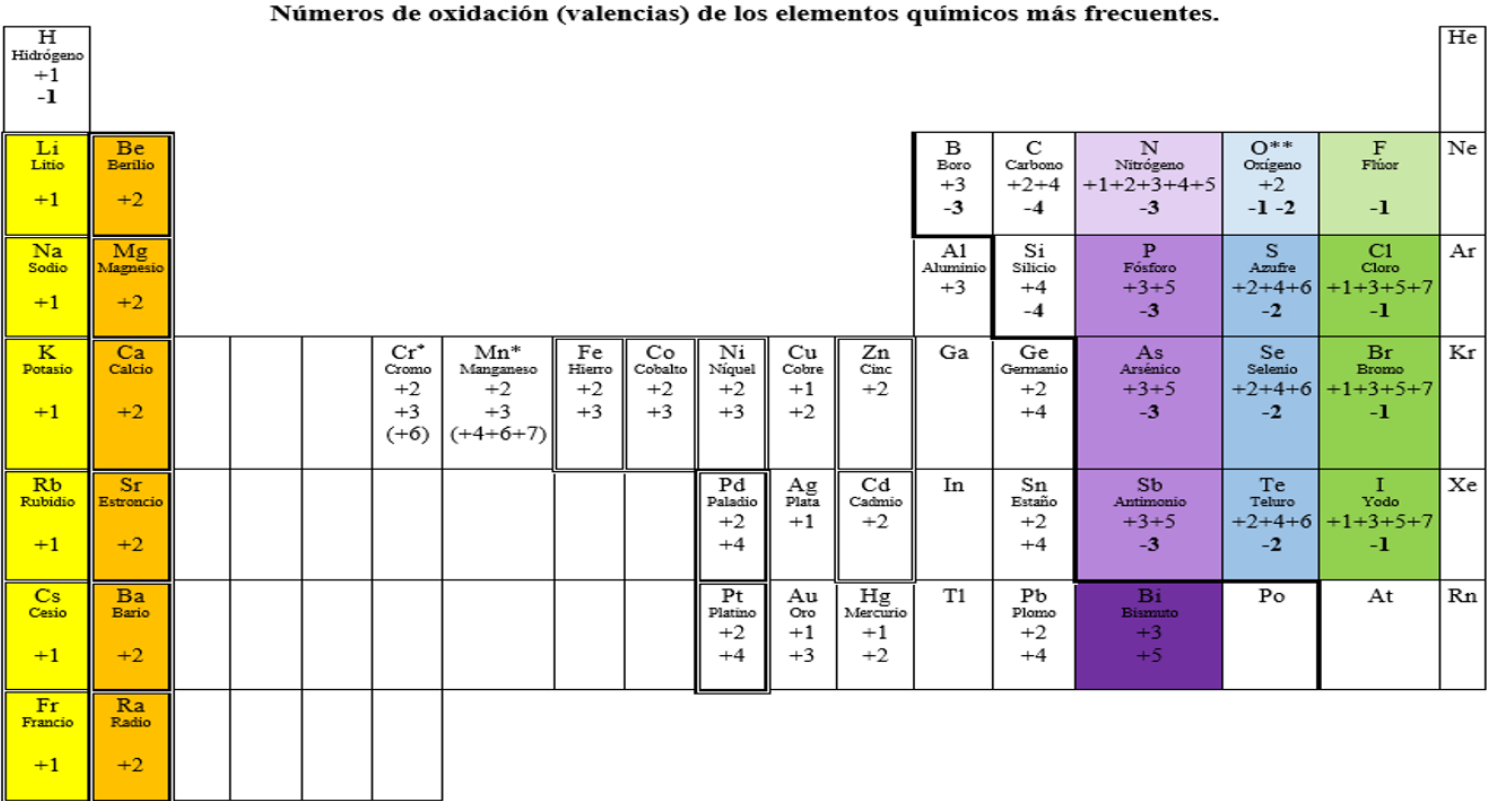
4. Números de oxidación
Llamamos número de oxidación de los elementos a la capacidad de combinación de los mismos.
Como ya se ha visto, los elementos se combinan entre sí formando moléculas o compuestos iónicos. En este proceso, cada átomo busca adquirir la configuración electrónica del gas noble que tiene más cercano (busca tener la misma cantidad de electrones). Algunos átomos (los metales) deberán perder los electrones de valencia, otros por el contrario (no metales) deberán ganarlos.
En los compuestos iónicos, el número de oxidación representa la cantidad de electrones que un átomo pierde o gana en dicho proceso. Ejemplo: el Na tiene 11 electrones en su estado elemental, el gas noble más cercano es el Ne que tiene 10. El Na tiende a perder un electrón al combinarse y de esta forma queda con carga +1. Ese es su estado o número de oxidación.
Si un elemento cede dos electrones su número de oxidación será +2 y si pierde tres electrones, será +3.
Otro ejemplo, el F tiene 9 electrones y busca adquirir la configuración electrónica del Ne que tiene 10 electrones y es el gas noble más cercano. Para ello el F tiende a ganar un electrón y queda con carga -1. Ese es su estado o número de oxidación.
Si un elemento gana dos electrones, su número de oxidación será -2 y si acepta tres electrones, será -3.
En los compuestos moleculares, como los átomos que intervienen son todos no metálicos (y por lo tanto no hay elementos que cedan electrones), la forma de adquirir la configuración electrónica del gas noble más cercano, será compartiendo electrones. El número de oxidación en este tipo de compuestos es la cantidad de electrones compartidos.
Algunos elementos tienen más de un número de oxidación, por ejemplo el Fe que tiene números de oxidación +2 y +3.
Para formular es fundamental recordar los números de oxidación de los elementos.