Ácidos e hidróxidos
| Sitio: | Aula Abierta - Facultad de Ingeniería |
| Curse: | Química Aplicada- 2025 (Cs. Basicas - Civ) |
| Libro: | Ácidos e hidróxidos |
| Impreso por: | Cuenta visitante |
| Fecha: | domingo, 1 de febrero de 2026, 05:53 |
1. Ácidos

Según Arrhenius, se consideran ácidos a aquellas sustancias que, al disolverse en agua, producen cationes hidrógeno (H+). Al catión hidrógeno también se lo llama protón.
Existen dos tipos de ácidos: los hidrácidos y los oxoácidos.HIDRÁCIDOS:
Son ácidos que no tienen oxígeno en su molécula. Son parte de los compuestos Binarios.
Cuando estudiamos hidruros no metálicos vimos que los siguientes hidruros gaseosos: HF, HCl, HBr, HI y H2S, cuando se disuelven en agua, se denominan hidrácidos. Su fórmula química no varía, sólo tenemos que tener en cuenta que al referirnos a estos compuestos en solución los nombramos como ácidos. El subíndice (ac) que se ve a la derecha de cada compuesto indica que están en solución acuosa:
OXOÁCIDOS:
Son ácidos que tienen oxígeno en su molécula. Son los denominados compuestos ternarios.
Presentan la fórmula general:
en donde X es normalmente un no metal combinado con hidrógeno y oxígeno.
Para nombrar los oxoácidos utilizaremos la nomenclatura Tradicional, clásica o funcional:
Derivan del nombre del anhídrido correspondiente cambiando la palabra anhídrido por ácido.
Así, se antepone la palabra ácido al nombre del elemento no metálico y la terminación del nombre dependerá del número de oxidación con el cual estará actuando el no metal.
· OSO, si el elemento no metálico forma ácidos con dos números de oxidación y actúa con el menor.
Ejemplo: El S cuando actúa con su menor número de oxidación +4 forma el anhídrido sulfuroso, luego ese anhídrido cuando se combine con agua formará el ácido sulfuroso.
· ICO, si el elemento no metálico forma ácidos con dos números de oxidación y actúa con el mayor.
Ejemplo: El N cuando actúa con su mayor número de oxidación +5 forma el anhídrido nítrico, luego ese anhídrido cuando se combine con agua formará el ácido nítrico.
· ICO, si el elemento no metálico forma ácido con un solo número de oxidación.
Ejemplo: H2CO3, ácido carbónico.
· Para elementos que pueden formar ácidos con cuatro números de oxidación, tomar como referencia la nomenclatura de los anhídridos correspondientes, utilizando los prefijos hipo y per y los sufijos oso e ico.
MÉTODO PARA OBTENER FÓRMULAS QUÍMICAS DE LOS OXOÁCIDOS:
Partiendo de la nomenclatura clásica o funcional del oxoácido y conociendo la fórmula química del anhídrido correspondiente.
1. Escribir la fórmula química del anhídrido, deducida del nombre del ácido correspondiente.
2. Sumarle una molécula de agua, indicando como subíndice las sumatorias de cada átomo.
3. Colocar los elementos en el siguiente orden: hidrógeno, no metal, oxígeno.
4. Simplificar los subíndices siempre que sea posible.
Ejemplo:
Algunas excepciones:
a. Ácido dicrómico (H2Cr2O7): sumar dos moléculas de anhídrido crómico y una molécula de agua.
b. Ácido ortofosforoso o fosforoso (H3PO3): sumar una molécula de anhídrido fosforoso y tres moléculas de agua.
c. Ácido pirofosfórico (H4P2O7): sumar una molécula de anhídrido fosfórico y dos moléculas de agua.
d. Ácido ortofosfórico o fosfórico (H3PO4): sumar una molécula de anhídrido fosfórico y tres moléculas de agua.
Los ácidos metafosforoso y metafosfórico, a partir de los respectivos anhídridos más una molécula de agua, y el ácido pirofosforoso, anhídrido más dos moléculas de agua, no existen , pero pueden ser escritos teóricamente. Sin embargo, existen las sales correspondientes.
OXOÁCIDOS DEL GRUPO DE LOS HALÓGENOS (ELEMENTOS DEL GRUPO VII DE LA TABLA PERIÓDICA):
Los halógenos (F, Cl, Br, I) que forman oxoácidos son: cloro, bromo y yodo. En los tres casos los números de oxidación pueden ser +1, +3, +5 y +7. Al tener más de dos estados de oxidación, para poder diferenciar los oxoácidos que forman, se utilizan los prefijos hipo-(que quiere decir menos que) y per-(que significa superior) junto a las terminaciones -oso e -ico: Veamos cómo:
OXOÁCIDOS DEL GRUPO DEL AZUFRE
De los oxoácidos de azufre, los más representativos son aquellos en los que el número de oxidación es +4 y +6. Para estos ácidos se utilizan los sufijos -oso e -ico. Veamos cómo:
OXOÁCIDOS DEL GRUPO DEL NITRÓGENO
Los ácidos más comunes del nitrógeno son el ácido nitroso y el ácido nítrico, en los que el nitrógeno presenta número de oxidación +3 y +5, respectivamente:
Ionización de ácidos
Los oxoácidos son compuestos covalentes polares que al disolverse en agua se disocian en iones, es decir se ionizan separando el catión hidrógeno (H+) y el resto de la molécula forma un anión con una carga negativa numéricamente igual a la cantidad de hidrógenos que tenía el ácido.
El nombre de los aniones se forma a partir del nombre del ácido, cambiando el sufijo oso por ito (en el caso que el elemento esté actuando con el menor número de oxidación). Ejemplo: ácido nitroso formará el anión nitrito. Y cambiando el sufijo ico del ácido por ato (para el caso en que el elemento esté actuando con su mayor número de oxidación). Ejemplo: ácido nítrico formará el anión nitrato.
Para recordar el cambio de sufijos de ácidos a aniones, puede resultar útil la siguiente regla mnemotécnica:
Oso bonito
Pico de pato
En el caso de los hidrácidos se cambia la terminación hídrico del ácido por uro. Ejemplo: el ácido clorhídrico forma el anión cloruro.
Entonces:
| Terminación del ácido | Terminación del anión |
|---|---|
| oso | ito |
| ico | ato |
| hídrico | uro |
Utilizando como ejemplo el ácido nitroso, a este proceso de ionización lo podemos representar a través de una ecuación química de la siguiente forma:
HNO2 (ac) H+ (ac) + NO2- (ac)
Ácido nitroso Anión nitrito
Conociendo los aniones, también se puede formar directamente el ácido, reemplazando el valor numérico de la carga del anión por los correspondientes cationes hidrógeno que neutralicen la carga. Recomendamos memorizar los aniones para formular en forma más rápida tanto los ácidos como las sales que se verán más adelante. |
|---|
A continuación les presentamos una tabla con los principales ácidos y sus respectivos aniones con los que trabajaremos:
HNO2 (ac) H+ (ac) + NO2- (ac)
Ácido nitroso Anión nitrito
HNO3 (ac)  H+ (ac) + NO3- (ac)
H+ (ac) + NO3- (ac)
Ácido nítrico Anión nitrato
H2CO3 (ac) 2 H+ (ac) + CO3-2 (ac)
Ácido carbónico Anión carbonato
H2SiO3 (ac)  2 H+(ac) + SiO3-2 (ac)
2 H+(ac) + SiO3-2 (ac)
Ácido silícico Anión silicato
H2SO3 (ac) 2 H+ (ac) + SO3-2 (ac)
Ácido sulfuroso Anión sulfito
H2SO4 (ac) 2 H+ (ac) + SO4-2 (ac)
2 H+ (ac) + SO4-2 (ac)
Ácido sulfúrico Anión sulfato
H3PO4 (ac) 3 H+(ac) + PO4 -3 (ac)
Ácido fosfórico u ortofosfórico Anión fosfato u ortofosfato
H3AsO4 (ac) 3 H+ (ac) + AsO3-3 (ac)
Ácido arsénico u ortoarsénico Anión arseniato u ortoarseniato
HClO (ac) H+ (ac) + ClO- (ac)
Ácido hipocloroso Anión hipoclorito
HClO2 (ac) H+ (ac) + ClO2- (ac)
Ácido cloroso Anión clorito
HClO3 (ac) H+ (ac) + ClO3- (ac)
H+ (ac) + ClO3- (ac)
Ácido clórico Anión clorato
HClO4 (ac)  H+ (ac) + ClO4- (ac)
H+ (ac) + ClO4- (ac)
Ácido perclórico Anión perclorato
HBrO (ac) H+ (ac) + BrO- (ac)
Ácido hipobromoso Anión hipobromito
HBrO2 (ac) H+ (ac) + BrO2- (ac)
H+ (ac) + BrO2- (ac)
Ácido bromoso Anión bromito
HBrO3 (ac) H+ (ac) + BrO3- (ac)
H+ (ac) + BrO3- (ac)
Ácido brómico Anión bromato
HBrO4 (ac) H+ (ac) + BrO4- (ac)
H+ (ac) + BrO4- (ac)
Ácido perbrómico Anión perbromato
HIO (ac) H+ (ac) + IO- (ac)
Ácido hipoyodoso Anión hipoyodito
HIO2 (ac) H+ (ac) + IO2- (ac)
H+ (ac) + IO2- (ac)
Ácido yodoso Anión yodito
HIO3 (ac) H+ (ac) + IO3- (ac)
Ácido yódico Anión yodato
HIO4 (ac) H+ (ac) + IO4- (ac)
H+ (ac) + IO4- (ac)
Ácido peryódico Anión peryodato
H2MnO4 (ac) 2 H+ (ac) + MnO4-2 (ac)
2 H+ (ac) + MnO4-2 (ac)
Ácido mangánico Anión manganato
HMnO4 (ac) H+ (ac) + MnO4- (ac)
H+ (ac) + MnO4- (ac)
Ácido permangánico Anión permanganato
H2CrO4 (ac) 2 H+ (ac) + CrO4-2 (ac)
2 H+ (ac) + CrO4-2 (ac)
Ácido crómico Anión cromato
H2Cr2O7 (ac)  2 H+ (ac) + Cr2O7-2 (ac)
2 H+ (ac) + Cr2O7-2 (ac)
Ácido dicrómico Anión dicromato
HF (ac) H+ (ac) + F - (ac)
Ácido fluorhídrico Anión fluoruro
HCl (ac)  H+ (ac) + Cl - (ac)
H+ (ac) + Cl - (ac)
Ácido clorhídrico Anión cloruro
HBr(ac) H+ (ac) + Br - (ac)
H+ (ac) + Br - (ac)
Ácido bromhídrico Anión bromuro
HI (ac) H+(ac) + I - (ac)
H+(ac) + I - (ac)
Ácido yohídrico Anión yoduro
H2S (ac) 2 H+ (ac) + S -2 (ac)
Ácido sulfhídrico Anión sulfuro
2. Hidróxidos
HIDRÓXIDOS O BASES
Antiguamente a estos compuestos también se los llamaba álcalis.
Las bases, a diferencia de los ácidos, tienen sabor amargo, son suaves al tacto pero corrosivos a la piel, dan color azul a ciertos colorantes vegetales, precipitan sustancias disueltas por ácidos, disuelven grasas y pierden sus propiedades cuando reaccionan con ácidos.
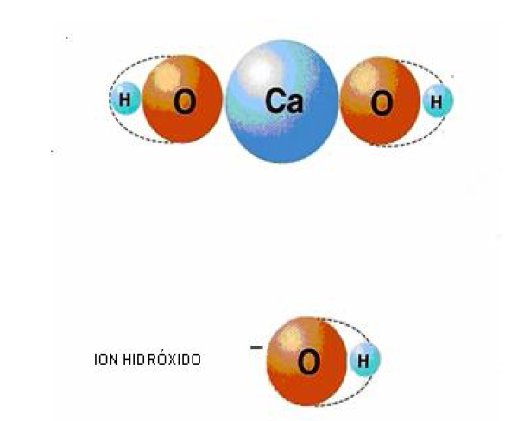
Son compuestos químicos que se forman por la combinación de un óxido básico con agua. Por ejemplo el óxido de calcio (cal viva) se combina con agua para formar hidróxido de calcio (cal apagada). Si representamos este proceso a través de una ecuación química:
CaO + H2O Ca(OH)2
Ca(OH)2
Según la definición del físico y químico sueco Svante Arrhenius, una base es un compuesto que, al disociarse en el agua, produce iones (OH)-, los cuales son llamados oxidrilos, hidroxilos o hidróxidos.
Por ejemplo, el NaOH en agua:
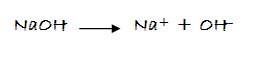

Donde Me es un metal y el subíndice a es el número de iones hidróxidos unidos al metal y que coincide con el número de oxidación con que está actuando el metal.
Veamos el siguiente ejemplo: Hidróxido de calcio. El calcio tiene un número de oxidación +2 y el grupo hidróxido -1. Para formar un compuesto final que resulte neutro, es necesario dos grupos hidróxidos unidos al calcio, y por lo tanto la fórmula final será: Ca(OH)2
Para formularlos utilizamos la regla del número de oxidación cruzado. Veamos algunos ejemplos:
Si queremos formular hidróxido cúprico: el Cu actúa con su mayor número de oxidación (dado que el nombre termina en ico) y el grupo hidróxido con -1. Al intercambiar los números de oxidación el compuesto final será: Cu(OH)2
Si queremos formular hidróxido de aluminio: el Al tiene número de oxidación +3 y el grupo hidróxido -1. El compuesto final será: Al(OH)3
Si queremos formular hidróxido de sodio: el Na tiene número de oxidación +1 y el grupo hidróxido -1. El compuesto final será: NaOH. Recuerden que el subíndice 1 en las fórmulas no se coloca. En este caso además, como el grupo hidróxido es uno solo, no se coloca el paréntesis.
Nomenclatura:
En general se nombran igual que los óxidos básicos pero cambiando la palabra óxido por hidróxido.
1. Nomenclatura tradicional o clásica
Se debe diferenciar entre elementos metálicos con un solo número de oxidación y elementos metálicos con dos números de oxidación para formar hidróxidos.
· Elementos metálicos con un solo número de oxidación: se nombran colocando las palabras Hidróxido de seguido del nombre del metal.
Ejemplo: NaOH, hidróxido de sodio.
· Elementos metálicos con dos números de oxidación:
- Con el menor número de oxidación: se nombran colocando la palabra Hidróxido seguido del nombre del metal terminado en oso.
Ejemplo Fe(OH)2, hidróxido ferroso.
- Con el mayor número de oxidación: se nombran colocando la palabra Hidróxido seguido del nombre del metal terminado en ico.
Ejemplo Fe(OH)3, hidróxido férrico.
2. Nomenclatura de Stock
· Elementos metálicos con un solo número de oxidación: ídem a la nomenclatura clásica.
· Elementos metálicos con dos número de oxidación: se nombran colocando las palabras Hidróxido de seguido del nombre del metal, indicando entre paréntesis y en números romanos, el número de oxidación con que actúa el metal.
Ejemplo: Ni(OH)2, hidróxido de níquel (II).
Ni(OH)3, hidróxido de níquel (III).

3. Nomenclatura sistemática, estequiométrica o de prefijos griegos
Anteponer el prefijo mono, di, tri, etc., según el número de iones oxhidrilo de la fórmula química, a la palabra hidróxido, seguido de la preposición de y a continuación el nombre del metal.
Ejemplo: Fe(OH)2, dihidróxido de hierro.
Las nomenclaturas que más utilizaremos para nombrar a los hidróxidos serán la tradicional y la de Stock.
Veamos estos tres ejemplos a modo de resumen:



Hidróxido de amonio, un caso especial:
Hemos visto que los hidróxidos se obtienen al combinar un óxido básico con agua. Pero el hidróxido de amonio no se obtiene por este camino, sino que lo hace al combinar el amoníaco (que es un hidruro no metálico) con agua. Si planteamos el proceso de obtención del hidróxido de amonio a través de una ecuación química:
NH3 + H2O NH4OH
NH4OH
Si quisiéramos formular este compuesto utilizando el método del número de oxidación cruzado, debemos tener en cuenta que el catión amonio tiene un número de oxidación +1 : NH4+ y el grupo hidróxido -1: OH- . Y por lo tanto, el compuesto final será NH4OH
El catión amonio, es el único catión poliatómico ( está constituido por 1 átomo de nitrógeno y 4 átomos de hidrógeno, y tiene una carga positiva de +1), no proviene de un metal y debe ser memorizado porque es muy utilizado en la formulación tanto del hidróxido de amonio como también en la de numerosas sales como se verá más adelante.
