Ácidos e hidróxidos
2. Hidróxidos
HIDRÓXIDOS O BASES
Antiguamente a estos compuestos también se los llamaba álcalis.
Las bases, a diferencia de los ácidos, tienen sabor amargo, son suaves al tacto pero corrosivos a la piel, dan color azul a ciertos colorantes vegetales, precipitan sustancias disueltas por ácidos, disuelven grasas y pierden sus propiedades cuando reaccionan con ácidos.
Son compuestos químicos que se forman por la combinación de un óxido básico con agua. Por ejemplo el óxido de calcio (cal viva) se combina con agua para formar hidróxido de calcio (cal apagada). Si representamos este proceso a través de una ecuación química:
CaO + H2O Ca(OH)2
Ca(OH)2
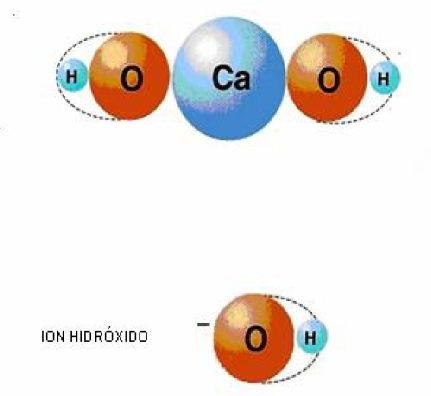
Según la definición del físico y químico sueco Svante Arrhenius, una base es un compuesto que, al disociarse en el agua, produce iones (OH)-, los cuales son llamados oxidrilos, hidroxilos o hidróxidos.
Por ejemplo, el NaOH en agua:
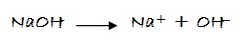

Donde Me es un metal y el subíndice a es el número de iones hidróxidos unidos al metal y que coincide con el número de oxidación con que está actuando el metal.
Veamos el siguiente ejemplo: Hidróxido de calcio. El calcio tiene un número de oxidación +2 y el grupo hidróxido -1. Para formar un compuesto final que resulte neutro, es necesario dos grupos hidróxidos unidos al calcio, y por lo tanto la fórmula final será: Ca(OH)2
Para formularlos utilizamos la regla del número de oxidación cruzado. Veamos algunos ejemplos:
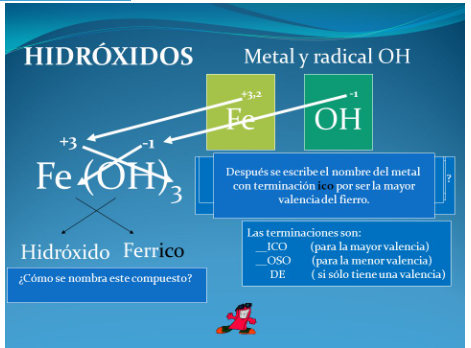
Si queremos formular hidróxido cúprico: el Cu actúa con su mayor número de oxidación (dado que el nombre termina en ico) y el grupo hidróxido con -1. Al intercambiar los números de oxidación el compuesto final será: Cu(OH)2
Si queremos formular hidróxido de aluminio: el Al tiene número de oxidación +3 y el grupo hidróxido -1. El compuesto final será: Al(OH)3
Si queremos formular hidróxido de sodio: el Na tiene número de oxidación +1 y el grupo hidróxido -1. El compuesto final será: NaOH. Recuerden que el subíndice 1 en las fórmulas no se coloca. En este caso además, como el grupo hidróxido es uno solo, no se coloca el paréntesis.
Nomenclatura:
En general se nombran igual que los óxidos básicos pero cambiando la palabra óxido por hidróxido.
1. Nomenclatura tradicional o clásica
Se debe diferenciar entre elementos metálicos con un solo número de oxidación y elementos metálicos con dos números de oxidación para formar hidróxidos.
· Elementos metálicos con un solo número de oxidación: se nombran colocando las palabras Hidróxido de seguido del nombre del metal.
Ejemplo: NaOH, hidróxido de sodio.
· Elementos metálicos con dos números de oxidación:
- Con el menor número de oxidación: se nombran colocando la palabra Hidróxido seguido del nombre del metal terminado en oso.
Ejemplo Fe(OH)2, hidróxido ferroso.
- Con el mayor número de oxidación: se nombran colocando la palabra Hidróxido seguido del nombre del metal terminado en ico.
Ejemplo Fe(OH)3, hidróxido férrico.
2. Nomenclatura de Stock
· Elementos metálicos con un solo número de oxidación: ídem a la nomenclatura clásica.
· Elementos metálicos con dos número de oxidación: se nombran colocando las palabras Hidróxido de seguido del nombre del metal, indicando entre paréntesis y en números romanos, el número de oxidación con que actúa el metal.
Ejemplo: Ni(OH)2, hidróxido de níquel (II).
Ni(OH)3, hidróxido de níquel (III).

3. Nomenclatura sistemática, estequiométrica o de prefijos griegos
Anteponer el prefijo mono, di, tri, etc., según el número de iones oxhidrilo de la fórmula química, a la palabra hidróxido, seguido de la preposición de y a continuación el nombre del metal.
Ejemplo: Fe(OH)2, dihidróxido de hierro.
Las nomenclaturas que más utilizaremos para nombrar a los hidróxidos serán la tradicional y la de Stock.
Veamos estos tres ejemplos a modo de resumen:

Hidróxido de amonio, un caso especial:
Hemos visto que los hidróxidos se obtienen al combinar un óxido básico con agua. Pero el hidróxido de amonio no se obtiene por este camino, sino que lo hace al combinar el amoníaco (que es un hidruro no metálico) con agua. Si planteamos el proceso de obtención del hidróxido de amonio a través de una ecuación química:
NH3 + H2O NH4OH
NH4OH
Si quisiéramos formular este compuesto utilizando el método del número de oxidación cruzado, debemos tener en cuenta que el catión amonio tiene un número de oxidación +1 : NH4+ y el grupo hidróxido -1: OH- . Y por lo tanto, el compuesto final será NH4OH
El catión amonio, es el único catión poliatómico ( está constituido por 1 átomo de nitrógeno y 4 átomos de hidrógeno, y tiene una carga positiva de +1), no proviene de un metal y debe ser memorizado porque es muy utilizado en la formulación tanto del hidróxido de amonio como también en la de numerosas sales como se verá más adelante.
Ionización de hidróxidos
Los hidróxidos cuando se encuentran fundidos o se disuelven en agua, se ionizan, es decir se separan en iones positivos (cationes) y negativos (aniones). Como ya se vio en la ionización de los ácidos, ,es por eso que conociendo los números de oxidación de los metales, sabiendo que el grupo oxhidrilo tiene carga -1 y utilizando el método del número de oxidación cruzado, formular hidróxidos resulta muy sencillo.
Aconsejamos memorizar los números de oxidación de los metales para formular en forma más rápida.
Este proceso se puede representar a través de una ecuación química de ionización o también llamada de disociación iónica, de la siguiente manera:
NaOH (ac)  OH- (ac) + Na+ (ac)
OH- (ac) + Na+ (ac)
Hidróxido de sodio Catión sodio
A continuación, veamos la ionización de algunos de los hidróxidos más utilizados:
KOH (ac) OH- (ac) + K+ (ac)
OH- (ac) + K+ (ac)
Hidróxido de potasio Catión potasio
Ca(OH)2 (ac) 2 OH- (ac) + Ca+2 (ac)
Hidróxido de calcio Catión calcio
Mg(OH)2 (ac) 2 OH- (ac) + Mg+2 (ac)
Hidróxido de magnesio Catión magnesio
Ba(OH)2 (ac) 2 OH- (ac) + Ba+2 (ac)
Hidróxido de bario Catión bario
Al(OH)3 (ac) 3 OH- (ac) + Al+3 (ac)
Hidróxido de aluminio Catión aluminio
Zn(OH)2 (ac) 2 OH- (ac) + Zn+2 (ac)
Hidróxido de cinc Catión cinc
Fe(OH)2 (ac) 2 OH- (ac) + Fe+2 (ac)
Hidróxido ferroso Catión ferroso
Fe(OH)3 (ac) 3 OH- (ac) + Fe+3 (ac)
Hidróxido férrico Catión férrico
Ni(OH)2 (ac) 2 OH- (ac) + Ni+2 (ac)
Hidróxido niqueloso Catión niqueloso
Ni(OH)3 (ac) 3 OH- (ac) + Ni+3 (ac)
3 OH- (ac) + Ni+3 (ac)
Hidróxido niquélico Catión niquélico
Cu(OH)2 (ac) 2 OH- (ac) + Cu+2 (ac)
Hidróxido cúprico Catión cúprico
Mn(OH)2 (ac) 2 OH- (ac) + Mn+2 (ac)
Hidróxido manganoso Catión manganoso
Mn(OH)3 (ac) 3 OH- (ac) + Mn+3 (ac)
3 OH- (ac) + Mn+3 (ac)
Hidróxido mangánico Catión mangánico
Sn(OH)2 (ac) 2 OH- (ac) + Sn+2 (ac)
Hidróxido estañoso Catión estañoso
Sn(OH)4 (ac) 3 OH- (ac) + Sn+4 (ac)
3 OH- (ac) + Sn+4 (ac)
Hidróxido estáñico Catión estáñico
NH4OH (ac) OH- (ac) + NH4+ (ac)
Hidróxido de amonio Catión amonio