4. Estructura de los compuestos orgánicos
5. Electronegatividad
Electronegatividad:
La electronegatividad es una medida de la capacidad de un átomo que está unido a otro para atraer hacia sí los electrones compartidos en el enlace covalente. Cuando dos átomos de distinta electronegatividad forman un enlace covalente, los electrones no se comparten equitativamente, sino que el de mayor electronegatividad atrae con más fuerza y esto da lugar a la formación de un enlace polar.
Ejemplo:
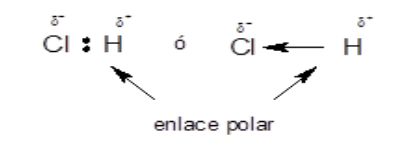

Es importante destacar que no todas las moléculas que tienen enlaces polares, son polares. Que la molécula sea polar o no polar depende de la combinación de las polaridades de los enlaces. Esta combinación se hace en forma similar a la suma de vectores. Por ejemplo, la molécula de tetracloruro de carbono no es polar, a pesar de tener enlaces polares, debido a que la configuración de la molécula (tetraédrica) determina que no haya un dipolo resultante de la suma de los enlaces polares. En cambio la molécula de agua, por su forma no lineal es una molécula polar.
El oxígeno del agua, y los carbonos de la molécula de tetracloruro de carbono tienen hibridación sp3, con ángulos de enlaces de aproximadamente 109º. En el caso de la molécula de agua, los dos pares de electrones sin compartir del oxígeno ocupan sendos orbitales híbridos.
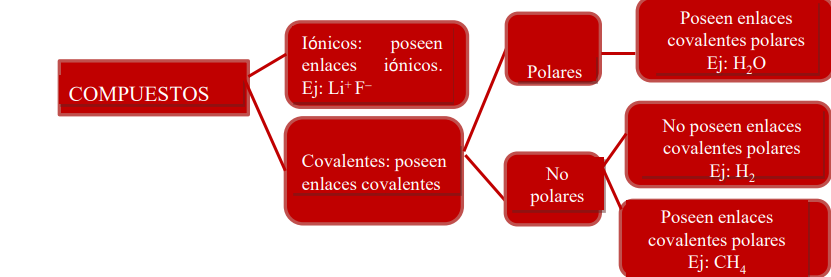
 Resumiendo, existen diferentes tipos de compuestos:
Resumiendo, existen diferentes tipos de compuestos: