5. Fuerzas intermoleculares
Fuerzas intermoleculares
Para comprender mejor este tema, vamos a repasar algunos conceptos fundamentales:
Electronegatividad:
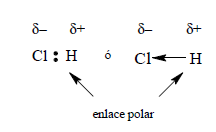
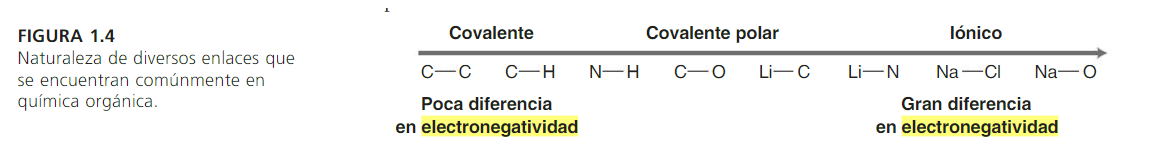
La electronegatividad es una medida de la capacidad de un átomo que está unido a otro para atraer hacia sí los electrones compartidos en el enlace covalente. Cuando dos átomos de distinta electronegatividad forman un enlace covalente, los electrones no se comparten equitativamente, sino que el de mayor electronegatividad atrae con más fuerza y esto da lugar a la formación de un enlace polar.
Ejemplo:
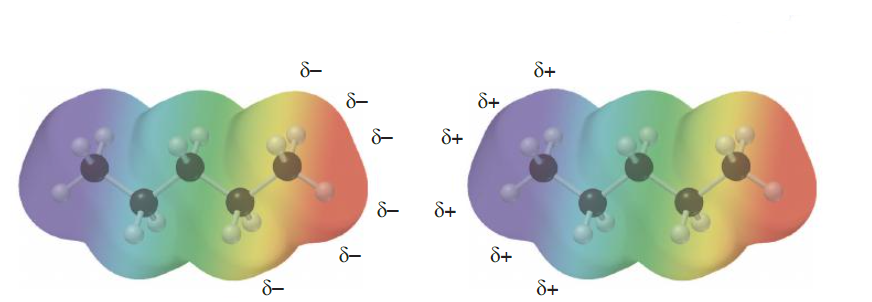
Es importante destacar que no todas las moléculas que tienen enlaces polares, son polares. Que la molécula sea polar o no polar depende de la combinación de las polaridades de los enlaces. Esta combinación se hace en forma similar a la suma de vectores. Por ejemplo, la molécula de tetracloruro de carbono no es polar, a pesar de tener enlaces polares, debido a que la configuración de la molécula (tetraédrica) determina que no haya un dipolo resultante de la suma de los enlaces polares. En cambio la molécula de agua, por su forma no lineal es una molécula polar.
El oxígeno del agua, y los carbonos de la molécula de tetracloruro de carbono tienen hibridación sp3, con ángulos de enlaces de aproximadamente 109º. En el caso de la molécula de agua, los dos pares de electrones sin compartir del oxígeno ocupan sendos orbitales híbridos.

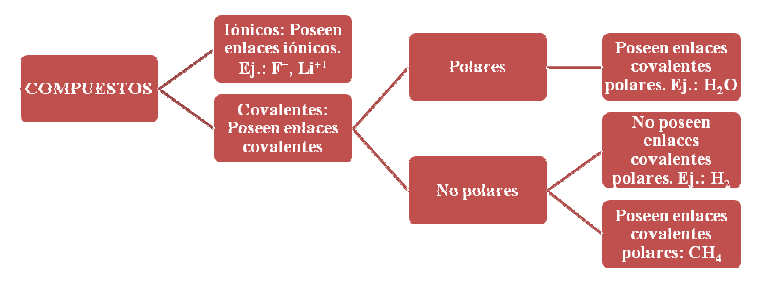
Resumiendo, existen diferentes tipos de compuestos:
Los invitamos a visualizar el siguiente video
Las propiedades físicas de un compuesto dan indicaciones sobre su estructura y a la vez, conociendo ésta, se pueden predecir las propiedades que presenta. Las grandes diferencias entre las propiedades físicas de los compuestos orgánicos proporcionan distintos medios de separación, caracterización e identificación de dichas sustancias.
Las propiedades físicas de un compuesto dependen generalmente del tipo de enlaces que mantienen unidos a sus átomos.
La correlación entre las propiedades físicas y la estructura depende de las interacciones o fuerzas intermoleculares.
Fuerzas intermoleculares
Estas son producidas por las mismas causas que las fuerzas de enlace dentro de las moléculas. Sin embargo, las interacciones intermoleculares implican distancias más grandes que las longitudes de enlaces ordinarias y las fuerzas entre las moléculas son más débiles que las que se encuentran en los enlaces químicos.
Las fuerzas intermoleculares más comunes son: atracción dipolo-dipolo, enlace por puente hidrógeno y fuerzas de Van der Waals.
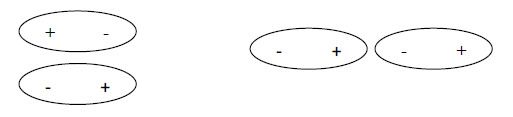
Atracción dipolo-dipolo
Dos moléculas polares se pueden asociar de manera que los polos con cargas opuestas ( δ+ y δ- ) queden próximos entre sí. El resultado de esto es una interacción atractiva neta o atracción dipolo-dipolo. Por lo tanto, la atracción dipolo-dipolo es la atracción electrostática entre estas regiones de carga positiva y carga negativa de diferentes moléculas.
Tanto en los líquidos como en los sólidos, hay una fuerte tendencia de los dipolos a alinearse y unir las moléculas.
Un tipo de atracción dipolo-dipolo fuerte es el enlace por puente de hidrógeno, que suele analizarse como otro tipo de fuerza intermolecular.
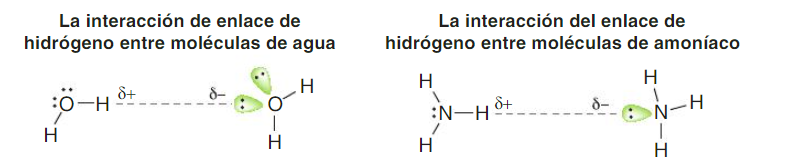
Enlace por puente de hidrógeno (asociación puente hidrógeno)
Los compuestos que contienen enlaces oxígeno- hidrógeno, nitrógeno-hidrógeno, flúor-hidrógeno, tienen una tendencia a la asociación mayor de la que podría esperarse teniendo en cuenta sus pesos moleculares y momentos dipolares.
Para que el enlace por puente de hidrógeno sea importante, los átomos electronegativos deben ser flúor, oxígeno o nitrógeno. Sólo es suficientemente positivo un hidrógeno unido a uno de estos elementos y sólo ellos son suficientemente negativos (ya que tienen la carga negativa concentrada sobre sus átomos pequeños) para que exista la atracción necesaria.
La magnitud de esta interacción atractiva varía con la electronegatividad de los átomos unidos al hidrógeno: cuanto más electronegativo es el átomo que está unido covalentemente al átomo de hidrógeno, mayor es la atracción que experimenta ese hidrógeno hacia una densidad electrónica adicional.
La unión por puente hidrógeno se representa con líneas de puntos:
Fuerzas de dispersión de London
Las fuerzas que existen entre las moléculas de un compuesto no polar se conocen como fuerzas de dispersión de London.
Se originan porque, a pesar que no hay un momento dipolar neto debido a la distribución simétrica promedio de cargas alrededor de una molécula, los electrones se desplazan de modo que, en un instante cualquiera, esa distribución probablemente se distorsionará y habrá un pequeño dipolo. Este dipolo momentáneo afectará la distribución de electrones en otra molécula cercana; el extremo negativo del dipolo tiende a repeler electrones, y el positivo a atraerlos; es decir, el dipolo induce un dipolo de orientación opuesta en la molécula vecina: