Compuestos halogenados
Nomenclatura
Son compuestos que se pueden considerar derivados de los hidrocarburos en los cuales se ha sustituido hidrógeno por halógeno.
Para nombrarlos se considera el halógeno como cualquier sustituyente alquílico y se siguen las mismas reglas que para los alcanos.
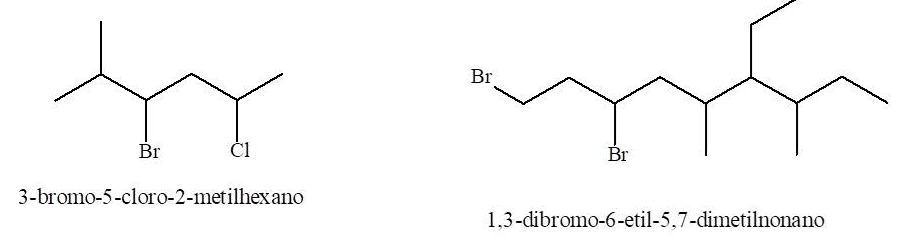
Aclaración: al dibujar compuestos con grupos funcionales mediante fórmulas de esqueleto se deben indicar todos los enlaces correspondientes a los heteroátomos.
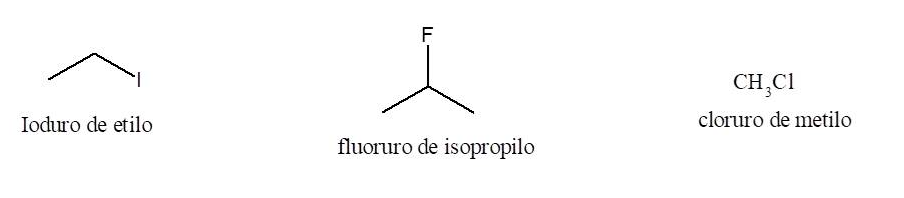
Los halogenuros de alquilo sencillos tienen un sistema de nomenclatura que no responden a las reglas IUPAC pero que está ampliamente difundido. Se los denomina simplemente halogenuros de alquilo.
Propiedades físicas

Estructura
y efecto inductivo
Uso de los halogenados
Extintores de fuego
Refrigerantes
Solventes
https://aulaabierta.ingenieria.uncuyo.edu.ar/pluginfile.php/139529/mod_page/content/15/Solventes.pdf


REACCIONES

Sustituciones nucleofílicas alifáticas
Las sustituciones nucleofílicas constituyen métodos útiles para preparar diversos tipos de compuestos.
En una reacción de sustitución un átomo o un grupo de átomos de una molécula se reemplazan por otro. Cuando el reactivo que ataca al núcleo del carbono (o atacante) es rico en electrones, reactivo nucleofílico o nucleófilo, la reacción es una Sustitución Nucleofílica. Por ejemplo, la sustitución del cloro en el cloruro de metilo por un grupo oxhidrilo:
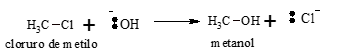
Este es un fenómeno heterolítico, el ión cloruro saliente se lleva el par de electrones que comparte con el carbono y el ión hidróxido entrante aporta el par de electrones necesarios para la unión con el carbono.
El ión halogenuro es una base muy débil, y de la misma forma que en el ácido libera el protón, en los halogenuros de alquilo libera el carbonio hacia otras bases. Estas bases poseen un par de electrones sin compartir y buscan un centro relativamente positivo, es decir buscan un núcleo con el cual compartir sus electrones.
Representación General:
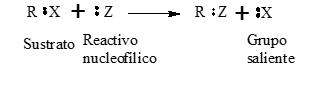
El compuesto carbonado que sufre la sustitución se denomina sustrato y es el que posee un grupo saliente, que es desplazado del carbono y se aleja de la molécula llevándose el par de electrones.
Si bien vamos a estudiar con mayor profundidad las sustituciones nucleofílicas en haluros de alquilo, otros compuestos pueden sufrir estas reacciones (ej.: preparación de haluros de alquilo a partir de alcoholes, obtención de derivados de ácidos, etc.).

Casi todos los compuestos que sufren sustitución nucleofílica (es decir los que tienen un grupo saliente en un átomo con hibridación sp3) también pueden sufrir eliminación, con formación de dobles o triples enlaces.
En una eliminación típica, un sustrato que tiene dos grupos (A y B) en carbonos adyacentes experimenta la ruptura de los dos enlaces que unen el esqueleto de carbono a dichos grupos. Dos de los cuatro electrones de los enlaces s aparecen en el producto como un enlace p. Los dos electrones restantes quedan ya sea como un par de electrones localizados en A o B, con producción de un anión y un catión, o como un enlace covalente entre los dos fragmentos. Al mismo tiempo, los dos átomos de carbono a los cuales A y B estaban unidos cambian su hibridación de sp3 a sp2
Formación de un doble enlace:
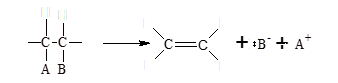
Formación de un triple enlace:
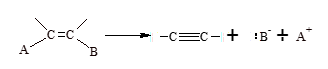
Los métodos de eliminación iónica, también conocidos como eliminación 1,2 más importantes por su aplicabilidad general son: deshidrohalogenación de halogenuros de alquilo y deshidratación de alcoholes.
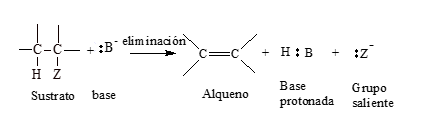
El sustrato, generalmente halogenuro de alquilo o alcohol, contiene un grupo saliente, átomo o grupo que abandona la molécula llevándose un par de electrones. En una posición b con respecto al grupo saliente, el sustrato contiene un átomo o grupo de átomos, casi siempre hidrógeno, que puede ser sacado por la base, dejando su par de electrones, con el que se forma el segundo enlace entre los carbonos.