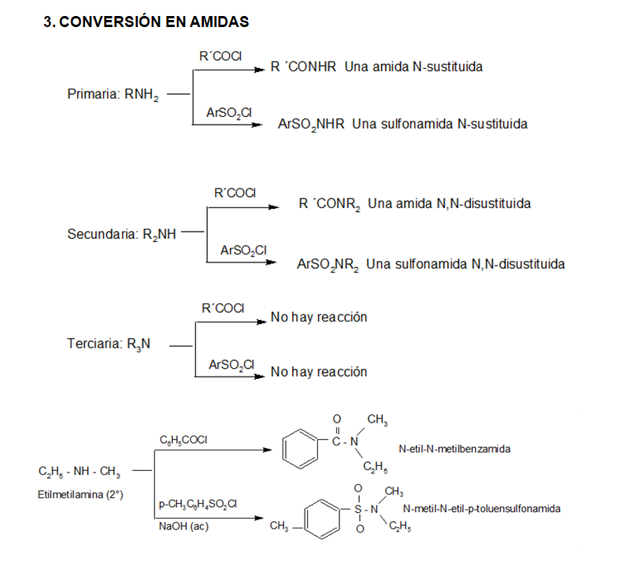
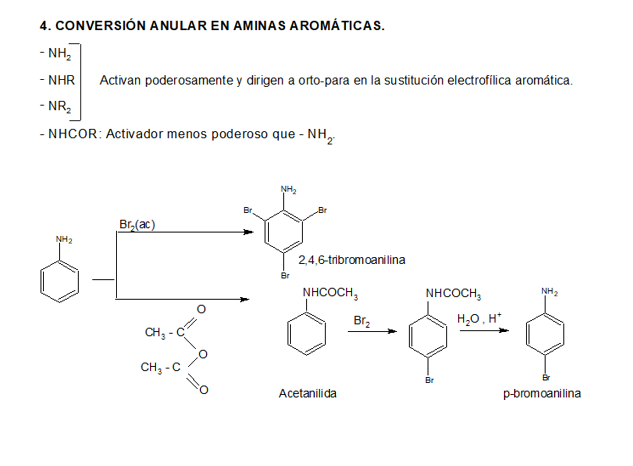
Compuestos nitrogenados
Nomenclatura
Las aminas son compuestos orgánicos relacionados con el amoníaco, que se forman al reemplazar uno, dos o los tres hidrógenos del amoníaco por grupos orgánicos (grupos alquilo, arilo o vinilo). El grupo funcional se denomina amino.
Dependiendo de la cantidad de grupos orgánicos unidos al nitrógeno se pueden clasificar como aminas primarias, secundarias o terciarias.
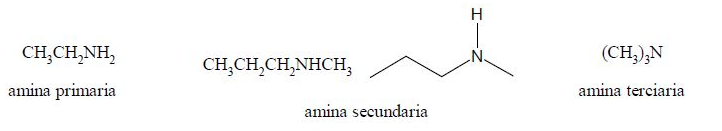
Las aminas pueden nombrarse de diferentes formas y no hay una clara preferencia de alguna de ellas por sobre las demás.
El sistema común para las aminas simples nombra cada sustituyente alquilo en el nitrógeno en orden alfabético, seguido por el sufijo -amina. Muchas aminas aromáticas y heterocíclicas son conocidas por los nombres comunes singulares, cuyos orígenes son a menudo desconocidos para los químicos que los utilizan con frecuencia. Puesto que estos nombres no se basan en un sistema racional, es necesario memorizarlos.
Según el sistema IUPAC, el grupo amino, -NH2, se nombra como un sustituyente en el mayor grupo alquilo, en aminas primarias. En este sistema, las aminas secundarias y terciarias se nombran utilizando prefijos que incluyen a todos los carbonos, menos a los de la cadena más larga.
Recientemente el Chemical Abstract Service (CA) introdujo un sistema por el cual las aminas se nombran como alcanaminas. En aminas 2º y 3º, los sustituyentes adicionales del nitrógeno son designados por el prefijo N- antes del grupo alquilo más largo, que se utiliza como la raíz del nombre.
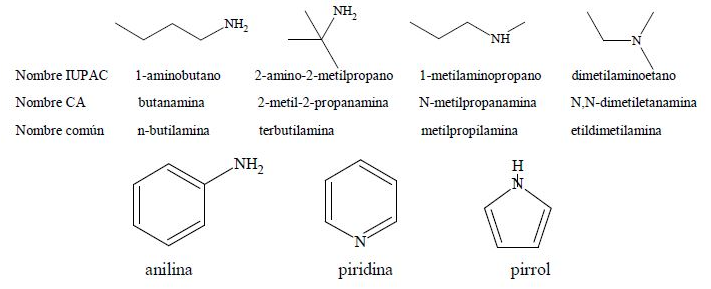
A continuación se muestran los diferentes nombres de las cuatro aminas isómeras de fórmula molecular C4H11N:
Les dejamos un video donde se explica la nomenclatura que más usaremos en este curso
Propiedades físicas
Las aminas son fuertemente polares debido a que el gran momento dipolar del par de electrones solitario se suma a a los momentos dipolares de los enlaces C↔N y H↔N. Las aminas primarias y secundarias tienen enlaces N—H, por lo que se forman enlaces de hidrógeno. Las aminas terciarias, como no tienen enlaces N — H, no formarán enlaces de hidrógeno, sin embargo, pueden participar como aceptares de enlaces de hidrógeno con mo léculas que tengan enlaces O — H o N — H.
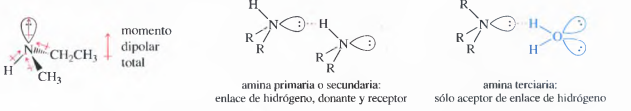
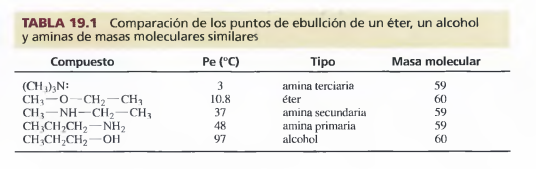
Como el nitrógeno es menos electronegativo que el oxígeno, el enlace N—H es menos polar que el enlace O — H, por lo tanto, las aminas forman enlaces de hidrógeno más débiles que los alcoholes con masas moleculares similares. Las aminas primarias y secundarias tienen puntos de ebullición más bajos que los de los alcoholes, pero más altos que los de los éteres con masas moleculares parecidas. Al no tener enlaces de hidrógeno, las aminas terciarias tienen puntos de ebullición más bajos que los de las aminas primarias y secundarias de masas moleculares similares. En la Tabla 19.1 se comparan los puntos de ebullición de un éter, un alcohol y aminas de masas moleculares parecidas.
Las aminas de bajo peso molecular son solubles en agua porque pueden formar puente hidrógeno con ella.
Las aminas primarias son más solubles que las secundarias porque las primarias tienen dos hidrógenos para formar puente hidrógeno.
las aminas terciarias tienen un par de electrones no enlazado que puede aceptar puente hidrógeno pero, a diferencia de las otras, carecen de hidrógenos que ceder para formar puente hidrógeno.
La solubilidad límite se da al tomar unos 6 átomos de C. Son solubles en disolventes menos polares, como alcohol, éter, alcohol, benceno, etc.
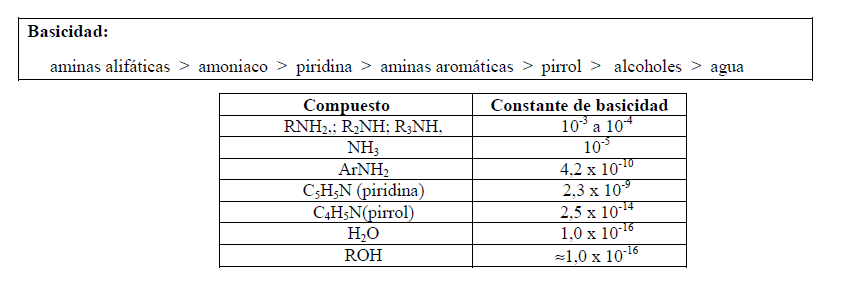
Basicidad de compuestos orgánicos
Los invitamos a visualizar el siguiente video:
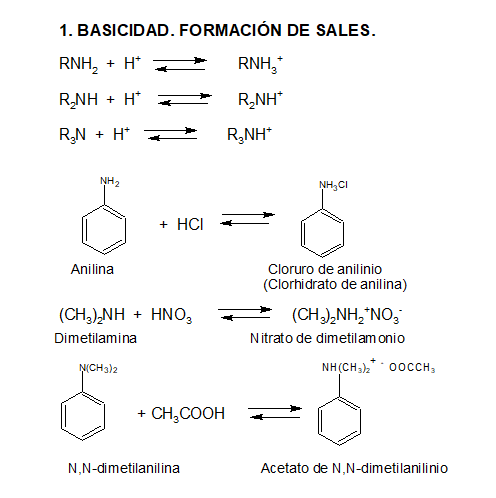
La basicidad de un compuesto se demuestra por su reacción frente a ácidos, de los que toman el protón para formar un catión:
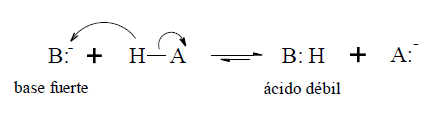
Se puede determinar la fuerza de una base mediante la siguiente reacción de equilibrio:
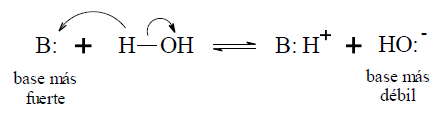
La constante de equilibrio para esta reacción es:
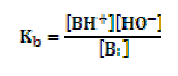
Por ejemplo, la aplicación de esta ecuación a una amina primaria, metilamina (H3CNH2) da:
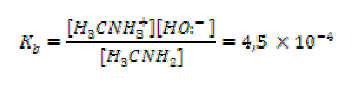
- Aminas
Las aminas poseen un par de electrones libres sobre nitrógeno, por lo tanto son bases de Lewis con un comportamiento químico semejante al del amoniaco. La tendencia del nitrógeno a compartir este par de electrones determina el comportamiento químico de las aminas: la basicidad, la acción nucleofílica y en el caso de las aminas aromáticas también la alta reactividad del anillo.
Las aminas reaccionan con ácidos minerales convirtiéndose en sales, de acuerdo a:
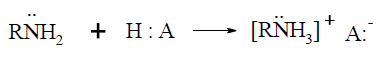
La basicidad depende de la posibilidad de acomodar una carga positiva. Comparando la fuerza como base de compuestos tales como un hidróxido, una amina primaria y el agua, experimentalmente resulta:
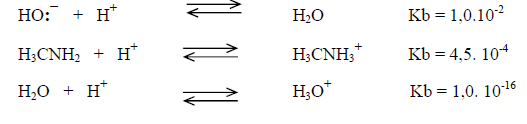
Por lo tanto:
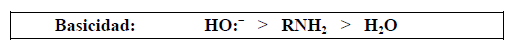
Las aminas también son más básicas que los alcoholes, éteres, ésteres, etc, porque el nitrógeno es menos electronegativo que el oxígeno y, además de ser mejor dador de electrones, puede acomodar mejor la carga positiva del catión.
Análisis de las estructuras de aminas alifáticas, aminas aromáticas y amoniaco:
Para analizar la basicidad de las aminas, se debe comparar las estabilidades de las mismas, con las de sus iones; mientras más estables sean estos en relación con las aminas de las que derivan, más básicas son aquellas.

Tanto el amoniaco como las aminas alifáticas y los correspondientes cationes pueden representarse satisfactoriamente con una sola estructura. En cambio las aminas aromáticas y sus cationes son híbridos de resonancia:
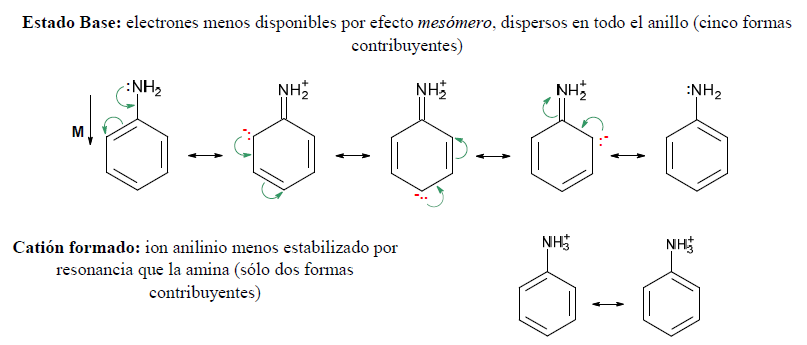
La anilina y el ión anilinio tienen un anillo bencénico, por lo que se estabilizarían por resonancia de una forma similar. Sin embargo, considerando también las estructuras adicionales que estabilizan a la anilina por resonancia, se observa que no se pueden elaborar formas similares para el ión anilinio, por lo que la estabilización es mayor para anilina que para su catión.
Teniendo en cuenta los diagramas de estructura molecular y posición de equilibrio se observa que la amina aromática estabilizada por resonancia es una base más débil que el amoniaco.
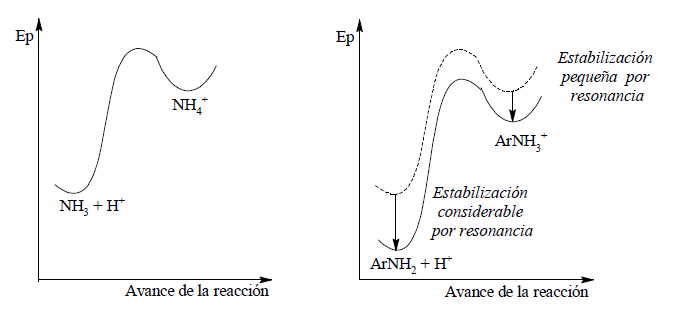
Por lo tanto:
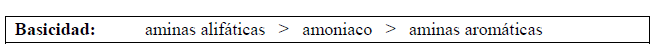
Análisis de las estructuras de aminas primarias, secundarias y terciarias:
Existen dos factores que afectan la basicidad de manera opuesta: el efecto inductivo por un lado, y la solvatación del ión formado por el otro.
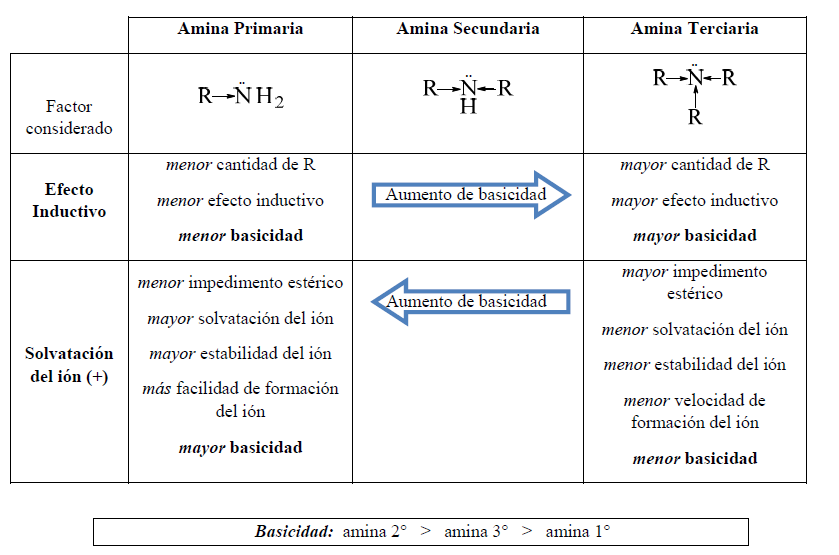
En aminas terciarias el factor estérico generado por los grupos R, dificulta la solvatación del ión, por lo que la basicidad de estas aminas es menor que la de las secundarias, y en algunos casos, menor que la de las primarias.
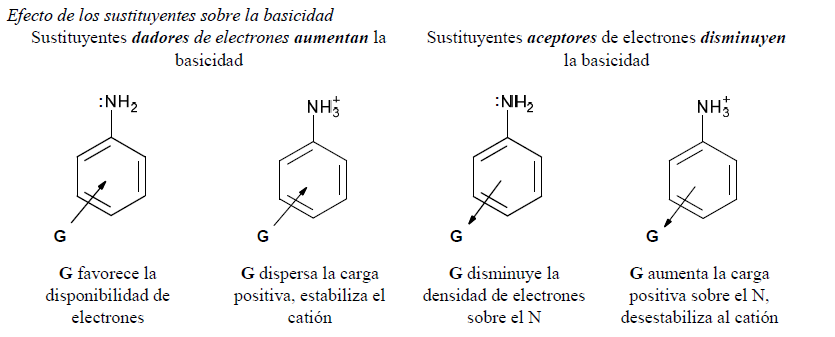
Los sustituyentes que aumentan la basicidad son dadores y son los que activan al anillo aromático para la sustitución electrofílica. A la inversa, los que la disminuyen son aceptores y son los que desactivan al anillo para estas sustituciones.
G es más efectivo cuando está en las posiciones orto y para respecto al grupo amino porque son esas posiciones las que ven aumentadas las densidades electrónicas por el efecto mesómero del grupo amino. Si en esas posiciones hay un aceptor, este refuerza el efecto mesómero del grupo amino, disminuyendo la basicidad.
Los grupos dadores de electrones generan un efecto opuesto al anterior, es decir aumentan la basicidad.
Sin embargo, se ha observado lo siguiente:
- los sustituyentes dadores de electrones disminuyen la basicidad cuando están en posición orto.
- los sustituyentes aceptores de electrones, que disminuyen la basicidad, lo hacen con más fuerza cuando están en posición orto.
A este efecto de los sustituyentes en orto se lo denomina efecto orto. Probablemente, se deba al efecto estérico en orto, que perjudica la solvatación del ión (+).
En la Tabla siguiente se muestran las Kb de anilina, metilanilinas y nitroanilinas:
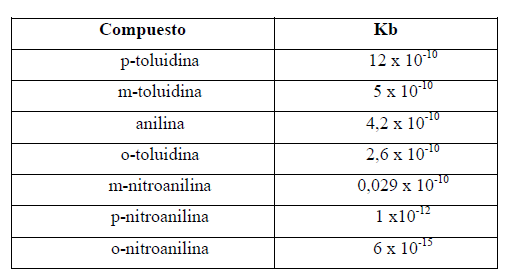
Se observa que o-toluidina tiene menos basicidad que anilina, a pesar de tener un grupo dador; del mismo
modo o-nitroanilina es menos básica que p- nitroanilina.
- Bases Heterocíclicas
- Pirrol
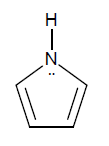
El pirrol es una base muy débil, Kb = 2,5 x 10-14, comparada con la mayoría de las aminas:
El pirrol es un híbrido de resonancia de las siguientes estructuras contribuyentes, donde la donación de electrones del nitrógeno al anillo queda indicada por las estructuras iónicas, en las que el nitrógeno tiene una carga positiva y los carbonos del anillo una negativa.
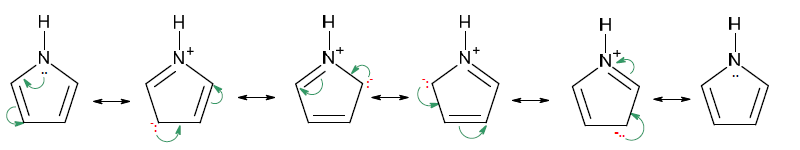
El par de electrones del nitrógeno, responsable de la basicidad de los compuestos nitrogenados, está comprometido en la nube p, por lo que no puede ser compartido con H+. Por este motivo, el pirrol presenta menor carácter básico que otros compuestos nitrogenados.
- Piridina
La piridina es una base, Kb = 2,3 x 10-9, más fuerte que pirrol:
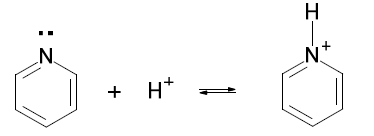
La piridina tiene un par de electrones en un orbital sp2 que puede compartir con H+ mientras que el pirrol sólo puede aceptar un ácido a expensas del carácter aromático del anillo.
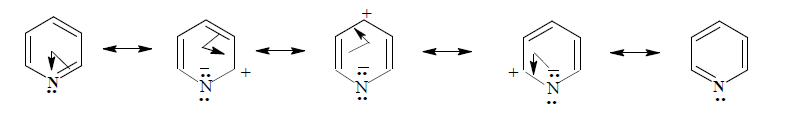
Es menos básica que las aminas alifáticas, ya que en éstas el par de electrones responsable de la basicidad ocupa un orbital sp3, con mayor carácter p que s. Al haber alto carácter p, el par de electrones es retenido menos firmemente, por lo que está más disponible para la reacción con un ácido.
En la piridina el par de electrones responsable de la basicidad se encuentra en un orbital sp2 y es retenido con más fuerza debido a su menor carácter p y mayor s que está más cerca del núcleo.
Resumiendo:

PREPARACIÓN
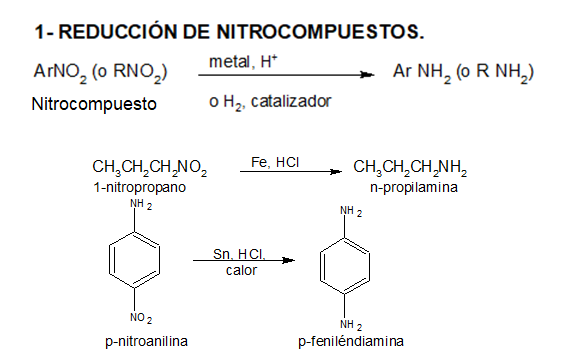
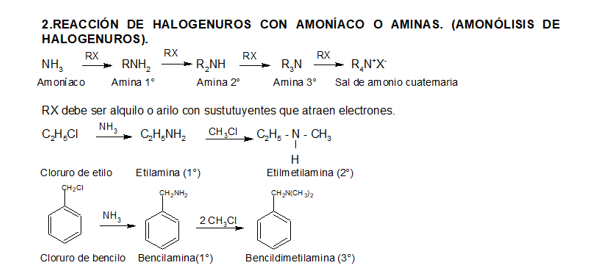
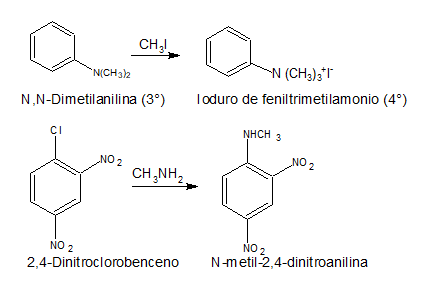
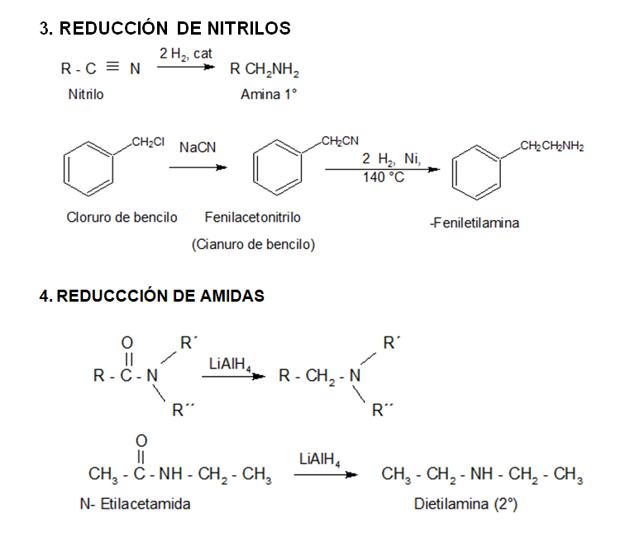
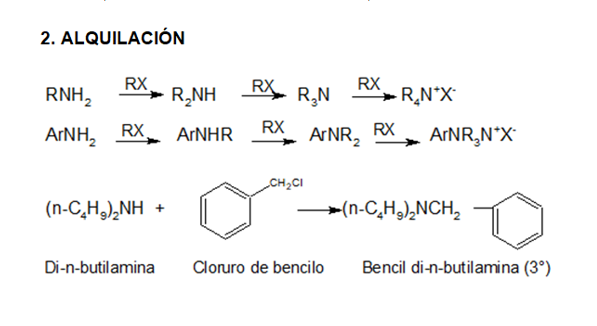
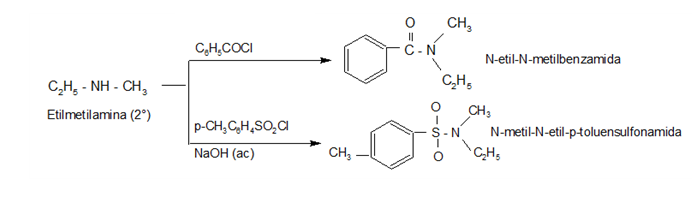
REACCIONES