4. Estructura de los compuestos orgánicos
2. Teoría estructural clásica
La fórmula estructural y la configuración no son representaciones sin sentido, sino que si se las analiza sobre la base de la Teoría Estructural se puede arribar a información acerca de las propiedades físicas y químicas de los compuestos. Dicha Teoría explica cuál es el orden de unión de los átomos en las moléculas y qué electrones los mantienen unidos.
En toda fórmula estructural hay enlaces químicos entre los átomos, que son las fuerzas que los mantienen unidos. La Teoría Estructural Clásica (antes de 1926) menciona dos tipos de enlaces:
Enlace iónico, donde hay transferencia de electrones
Enlace covalente, donde se comparten los electrones.
Tanto en el enlace iónico como en el covalente, cada átomo tiende a tomar la configuración electrónica del gas noble más próximo. A continuación se dan dos ejemplos a fin de interpretar ambos tipos de enlaces:
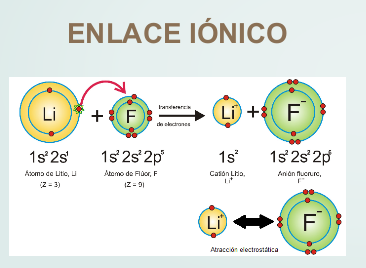
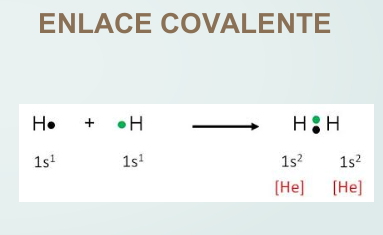
En los átomos que forman enlaces se puede observar lo siguiente:
El átomo de litio, al perder un electrón, queda con dos electrones, tomando la configuración del helio, mientras que el flúor, al ganar un electrón, queda con ocho electrones en su capa de valencia, tomando la configuración del neón. En el caso del hidrógeno, que tiene un electrón, al formar enlace presenta dos electrones como el helio.
Así, en la mayoría de los casos, para tomar la configuración del gas noble más próximo, se perderán, o ganarán o compartirán tantos electrones hasta quedar con dos (hidrógeno, litio) u ocho electrones en la capa de valencia. En este último caso, que es el más común, se dice que el átomo completa el octeto.
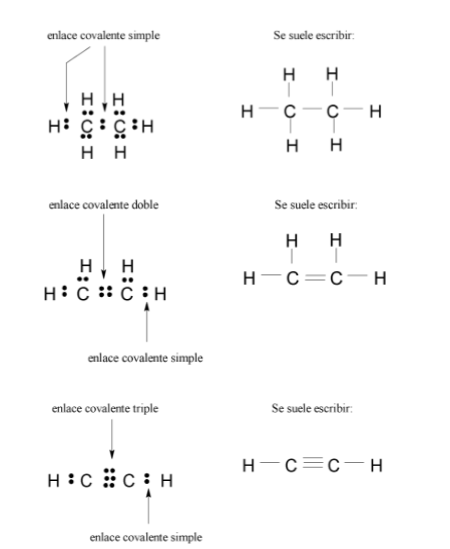
Por otro lado, es importante indicar que el enlace covalente puede ser, además de simple como en la molécula de hidrógeno, doble o triple.
Ejemplos: