4. Estructura de los compuestos orgánicos
3. Teoría del enlace de valencia
Para establecer la estructura según la Teoría del Enlace de Valencia, se debe considerar la hibridación del carbono, entendiéndose por hibridación la mezcla y reorientación en el espacio de orbitales atómicos.
Es importante aclarar que la hibridación de orbitales atómicos puros da por resultado orbitales atómicos no puros o híbridos.
Si bien la hibridación es el resultado de cálculos complejos realizados por la Mecánica Cuántica, en este curso sólo veremos las conclusiones del análisis.
Las ideas clave de esta teoría son las siguientes:
-
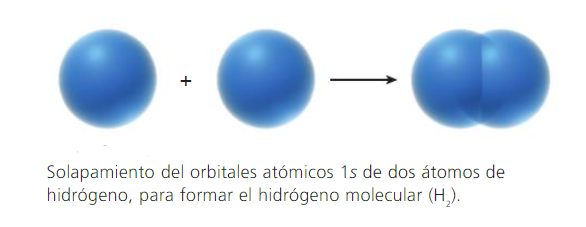
Los enlaces covalentes se forman por traslape (solapamiento) de dos orbitales atómicos (puros o híbridos), cada uno de los cuales tiene un electrón con espines opuestos.
-
Cada átomo enlazado retiene sus orbitales atómicos, y el par de electrones con espines opuestos comparte el espacio común entre ambos núcleos. Los electrones de la región de solapamiento, son atraídos simultáneamente por ambos núcleos, lo que mantiene unidos a los átomos.
-
Mientras mayor es el traslape de orbitales, el enlace es más fuerte.
-
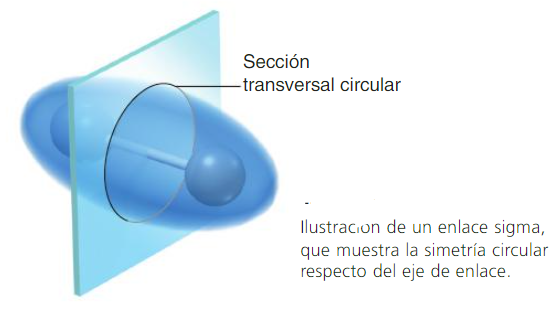
Los enlaces que se forman por el traslape de frente de dos orbitales atómicos a lo largo de una línea que une ambos núcleos, se llaman enlaces sigma (σ).
-
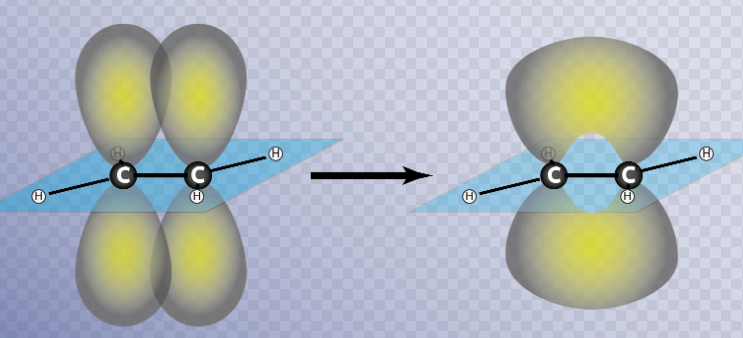
Los enlaces tipo pi (π) se forman por solapamiento lateral de dos orbitales atómicos.
-
-
-
Los invitamos a visualizar los videos del profesor Ernesto Brunet Romero para conocer las hibridaciones del C que trabajaremos en las siguientes unidades