4. Estructura de los compuestos orgánicos
4. Teoría de la resonancia
- Resonancia es, básicamente, deslocalización de electrones pi.
- La resonancia o deslocalización de electrones se presenta en moléculas con dobles o triples enlaces conjugados (ej.: 1,3-butadieno), pero también en otras especies químicas como radicales libres, aniones y cationes

Hay pruebas (ej.: longitudes de enlaces) que demuestran, que por sí mismas cada una de ellas no representa a la especie química correspondiente. No se observa que en cada una hay deslocalización de electrones pi. Por ejemplo, si tuviéramos que escribir la estructura del 1,3-butadieno, pondríamos:
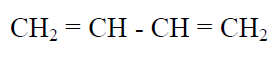

Sin embargo esta no es la verdadera estructura del compuesto, ya que al poseer dobles enlaces conjugados, presentaría deslocalización de electrones pi. Por lo tanto la estructura dada, por sí misma, no representaría al compuesto. Podríamos haber escrito distintas estructuras con distintas posiciones de los electrones móviles (pi), pero ninguna en forma aislada representaría al compuesto:


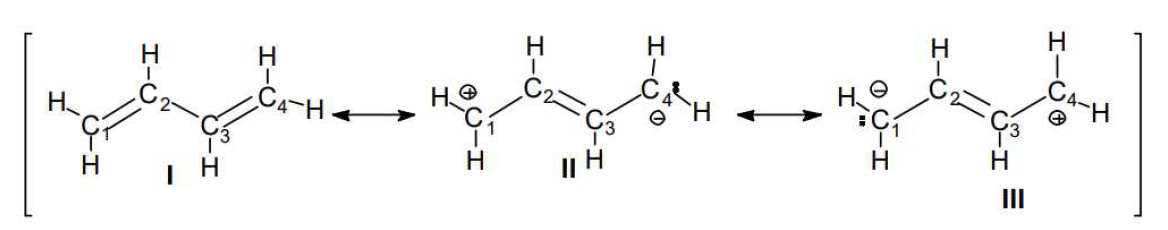
Entonces, la Teoría de la Resonancia postula que “si pueden escribirse dos o más estructuras correspondientes a un mismo compuesto, que difieran únicamente en las posiciones de los electrones, ninguna de las estructuras estará en concordancia con las propiedades del compuesto y, por lo tanto, no lo representa”.
Cuando hay conjugación una única estructura no representa al compuesto porque en los dobles enlaces, además de los electrones sigma que están más retenidos compartidos entre dos núcleos, los pi están menos retenidos. Entonces si esos electrones pertenecen a un doble enlace aislado, es compartido por dos núcleos, estando menos retenidos que los sigma (ej.: eteno). Pero si hay conjugación, en realidad esos electrones móviles pasan a moverse por toda la zona donde hay conjugación (ej.: 1,3-butadieno).
La Teoría de la Resonancia propone que esas estructuras sean utilizadas como "contribuyentes" a la estructura real, y las llama estructuras contribuyentes, o canónicas o de resonancia. No son estructuras reales.
¿Cómo representamos al compuesto?
Escribiendo las estructuras contribuyentes, que pueden ser dos o más, y entre dos estructuras se coloca una flecha de dos puntas que es el símbolo de la resonancia. Por ejemplo, al 1,3-butadieno lo representaremos como sigue:

Tratemos de comprender mediante un ejemplo a escala mayor, como es el caso de un objeto que se mueve (ej.: una pelota de fútbol que cae desde un muro). Si nosotros quisiéramos dibujar en un papel a la pelota cayendo desde el muro, no podríamos. Pero sí podemos hacer una secuencia con distintas posiciones de la pelota y el conjunto nos dará la idea de la caída:
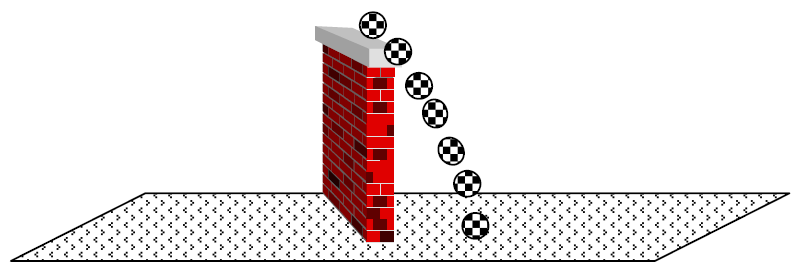

Ninguna de las pelotas en forma aislada representa la caída, pero el conjunto da idea del movimiento. Así, como no se puede representar en el plano el movimiento de los electrones en el 1,3-butadieno, se escriben distintas estructuras, cada una de las cuales por sí misma no indica el movimiento de los electrones, pero en conjunto dan idea del mismo.
La TEV, establecida con posterioridad a la Teoría de la Resonancia, permite comprender mejor la deslocalización de electrones.
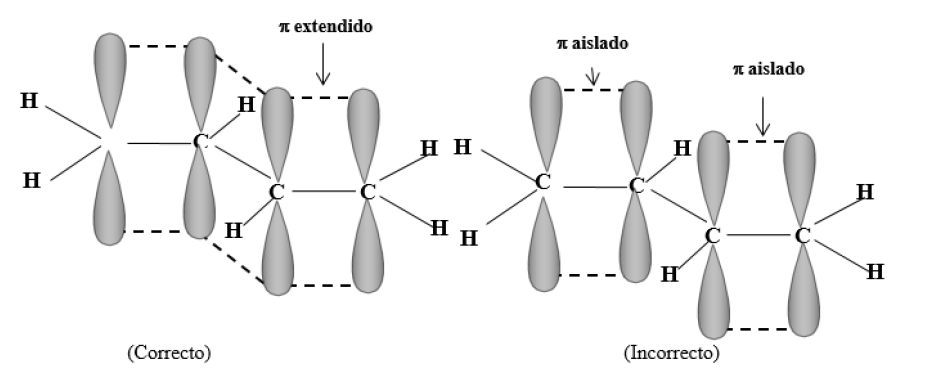
Por ejemplo, en el 1,3-butadieno todos los carbonos tienen hibridación sp2. Se forman los enlaces sigma orientados en un mismo plano, por solapamiento de orbitales híbridos entre sí (enlaces C1 - C2 , C2 - C3 , C3 - C4 ) y de orbitales híbridos con 1s de hidrógeno (enlaces C-H).
A cada carbono le queda un orbital pz con un electrón y, además, todos estos orbitales p están paralelos, lo que permite la formación de una nube pi extendida (cada orbital p se puede solapar con los dos orbitales p vecinos), ocupada por los electrones que originalmente eran pz (cada electrón se mueve en un espacio mayor, asociado a cuatro núcleos, que el que correspondería a un pi aislado):