ISOMERÍA
3. Isomería espacial o estereoisomería
3.2. Isomería geométrica
Este tipo de isomería se debe al impedimento a la rotación en torno de un doble enlace (C=C o C=N). Recordemos que el enlace π se forma sólo si los orbitales p son paralelos. Para que haya rotación se debería romper el enlace π, y éste podría volver a formarse cuando los orbitales p quedaran nuevamente paralelos.
Como consecuencia del impedimento a la libre rotación en un doble enlace, las configuraciones (I) y (II) son distintas y cada una responde a un compuesto determinado:
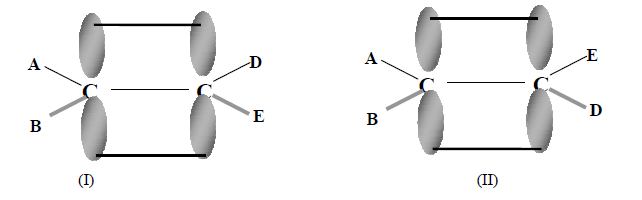
Aunque se gire (II) en torno de distintos ejes, nunca coincidirá con (I). Son dos configuraciones diferentes. Se dice que no son superponibles, y se las llama diasterómeros. Ejemplo: Compuestos de fórmula molecular C4H8 y estructura CH3-CH=CH-CH3 (2-buteno), se presenta en dos formas diferentes:
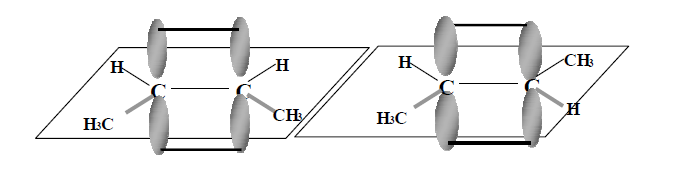
Una representación más simple es la siguiente:

Cis significa “del mismo lado”, mientras que trans “de lados opuestos”. Es decir, en el cis-2-buteno los grupos metilo están del mismo lado del plano perpendicular al plano donde se orientan los enlaces σ y en el trans 2-buteno los grupos metilo están de lados opuestos respecto al mismo plano.
Al principio hablamos del impedimento a la rotación en torno al doble enlace, pero hay otra condición para que haya isomería geométrica y es que cada carbono del doble enlace debe ir unido a dos átomos o grupos de átomos distintos. Es decir, para que haya isomería geométrica se debe cumplir:
1º Existencia de doble enlace (C=C ó C=N).
En este curso consideraremos sólo compuestos con enlaces C=C, pero debemos tener en cuenta que también puede haber isomería geométrica con unión C=N.
2º Cada carbono del doble enlace debe ir unido a dos átomos o grupos de átomos distintos. Los ejemplos siguientes explican por qué para que haya isomería geométrica se debe cumplir también esta segunda condición:
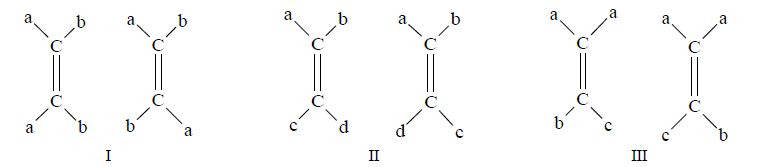
(I) Son dos configuraciones distintas, aunque movamos según distintos ejes una de las moléculas nunca coincidirá con la otra. Se trata de dos isómeros.
(II) Son dos configuraciones distintas, aunque movamos según distintos ejes una de las moléculas nunca coincidirá con la otra. Se trata de dos isómeros.
En (III) no hay isomería, hemos representado al mismo compuesto dos veces. Si imaginamos un eje paralelo al papel y giramos la segunda molécula, observamos que coincide con la primera.
Les dejamos un video del profesor Ernesto Brunet Romero
Sistema E-Z
Cuando encontramos compuestos como el 1-bromo-2-cloropropeno, en donde los cuatro sustituyentes son diferentes no se puede usar el sistema cis-trans de nomenclatura. Para este tipo de compuestos se inventó el sistema Z-E
Para dar nombre a un isómero con esta nomenclatura se trabaja de la siguiente manera:
Se determinan las prioridades relativas de los dos grupos unidos a cada uno de los carbonos sp2. Dicha prioridad se determina según el número atómico de los átomos directamente unidos a cada uno de los C que participan del doble enlace. El átomo de mayor número atómico tiene la mayor prioridad.
Si el doble enlace presenta los dos grupos de mayor prioridad del mismo lado del plano de referencia se le asigna la configuración Z (del alemán zusammen) Cis: (Si los grupos son iguales)
Si el doble enlace presenta los dos grupos de mayor prioridad de lados opuestos del plano de referencia se le asigna la configuración E (del alemán entgegen) Trans: (Si los grupos son iguales)
Entonces en el 1-bromo-2-cloropropeno uno de los carbonos sp2 está unido a un Br y un H. El número atómico del bromo es mayor que el del hidrógeno, de modo que el Br es el de mayor prioridad. El otro carbono sp2 está unido a un Cl y a un C. El cloro tiene el número atómico mayor, por lo que es el prioritario.

Si los dos grupos unidos a un carbono sp2 comienzan en el mismo átomo (hay un empate) habrá que alejarse del punto de unión y tener en cuenta los números atómicos de los átomos unidos a los átomos empatados
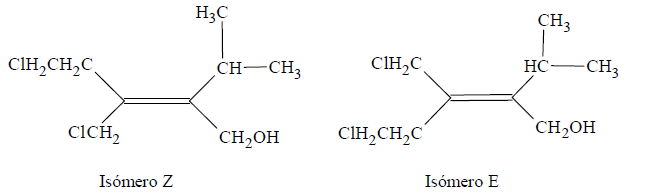
El C del grupo CH2Cl está unido a Cl, H, H y el C del grupo CH2CH2Cl está enlazado con C, H, H. El Cl tiene mayor número atómico que el C, de manera que el grupo CH2Cl tiene mayor prioridad. Lo mismo ocurre con los sustituyentes del otro C con hibridación sp2 siendo el grupo prioritario CH2OH por poseer el O el mayor número atómico.
Les dejamos un video del profesor Juan Antonio Llorens Molina