Repasemos algunos conceptos importantes antes de formular...
1. Elementos químicos
ELEMENTOS QUÍMICOS
Constitución de la materia. Conceptos importantes:
Por medio de especulaciones filosóficas los antiguos griegos llegaron a la idea de que la materia está formada por partículas muy pequeñas imposibles de dividir a las que denominaron átomos (significa indivisible). Posteriormente y a través de la experimentación los científicos arribaron a la conclusión de que toda la materia está formada realmente por átomos.
Átomo es la menor porción de materia capaz de combinarse para formar moléculas.
Actualmente se sabe que sí se puede dividir en partículas más pequeñas, llamadas subatómicas, entre las cuales las más importantes son los protones, neutrones y electrones.
Los átomos rara vez se encuentran libres en la naturaleza, sino que se combinan para formar partículas más estables, denominadas moléculas.
Molécula es la menor partícula de una sustancia, formada por átomos combinados en proporción definida y constante, que puede existir libre y presenta todas las propiedades de dicha sustancia. Por ejemplo, el agua es una molécula formada por dos átomos de hidrógeno y
uno de oxígeno.
Representación de las moléculas:
Las moléculas se representan en forma abreviada por medio de las fórmulas químicas. Las sustancias pueden ser simples o compuestas.
Sustancias simples: son las formadas por un mismo tipo de átomos. El número de átomos que constituyen la molécula de las sustancias simples se denomina atomicidad. Algunas sustancias como los gases nobles (He, Ne, Ar, etc.) o los metales (Na, K, Ca, mg, etc.) tienen moléculas constituídas por un solo átomo y se denominan monoatómicas. Algunos átomos como los de fluor (F), cloro (Cl), bromo (Br), iodo (I), oxígeno (O), hidrógeno (H) y nitrógeno (N) no pueden existir solos, así que se unen de a dos formando moléculas denominadas diatómicas y se representan como F2, Cl2, Br2, I2, O2, H2 y N2. El símbolo representa un átomo y el número (2 en estos casos) escrito a su derecha y abajo indica la cantidad de átomos que forman la molécula. Existen también moléculas que provienen de la unión de varios átomos iguales (tres o más) y se denominan poliatómicas. Por ejemplo el P4 (fósforo blanco), O3 (ozono).
Sustancias compuestas: están formadas por átomos distintos. Ejemplo: el dióxido de carbono se representa a través de la molécula CO2, formada por un átomo de carbono y dos de oxígeno.
Para indicar dos o más moléculas se coloca delante de la fórmula el número correspondiente que se denomina coeficiente. Ejemplo: 2 H2O significa dos moléculas de agua; 3 O2 significa tres moléculas de oxígeno.
Elementos y sus símbolos. Concepto
Los elementos son las unidades químicas fundamentales que forman las sustancias simples y compuestas. Son los distintos tipos de átomos.
En la actualidad se han identificado 119 elementos de los cuales aproximadamente 90 se encuentran en la naturaleza y los restantes son artificiales, es decir, obtenidos por el hombre en el laboratorio a través de procesos nucleares.
Los nombres de los elementos provienen del griego o derivan del latín y hacen referencia a alguna propiedad importante del elemento como por ejemplo barys (bario) que significa pesado. Los más recientemente descubiertos se nombran teniendo en cuenta el lugar de descubrimiento como el germanio por Germania (Alemania), o en homenaje a destacados investigadores como el einstenio por Einstein.
Símbolos químicos
Los elementos se representan por medio de símbolos de una o dos letras. Por ejemplo C es el símbolo para el carbono, Ca para el calcio, Cu para el cobre, Co para el cobalto, etc. La primera letra siempre se escribe en mayúscula y la segunda letra se escribe en minúscula.
Los símbolos de algunos elementos derivan del nombre griego o latino por ejemplo Fe de ferrum (hierro) o Na de natrium (sodio).
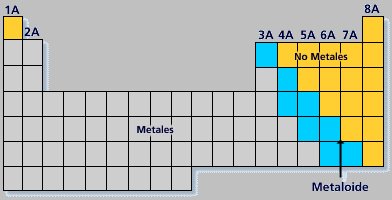
Clasificación y propiedades de los elementos
Los elementos, de acuerdo a sus propiedades se pueden clasificar en tres grandes grupos:
- Metales.
- No metales.
- Gases inertes.
Ubicación de los elementos en la Tabla Periódica
El nombre, símbolo e información relevante de todos los elementos puede encontrarse en la Tabla Periódica, en la cual se puede observar la distribución de los elementos de acuerdo a la clasificación mencionada.