Repasemos algunos conceptos importantes antes de formular...
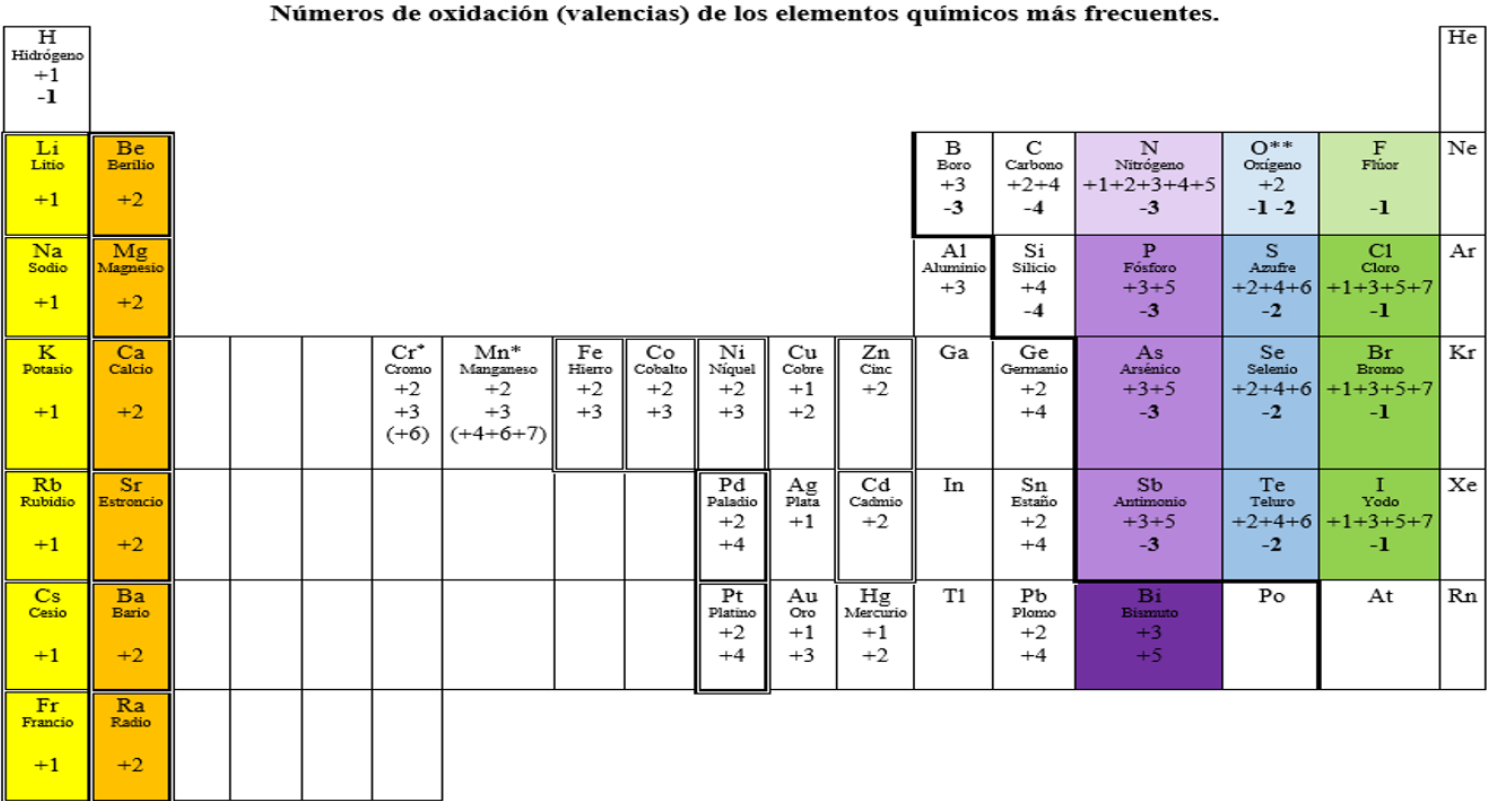
4. Números de oxidación
Llamamos número de oxidación de los elementos a la capacidad de combinación de los mismos.
Como ya se ha visto, los elementos se combinan entre sí formando moléculas o compuestos iónicos. En este proceso, cada átomo busca adquirir la configuración electrónica del gas noble que tiene más cercano (busca tener la misma cantidad de electrones). Algunos átomos (los metales) deberán perder los electrones de valencia, otros por el contrario (no metales) deberán ganarlos.
En los compuestos iónicos, el número de oxidación representa la cantidad de electrones que un átomo pierde o gana en dicho proceso. Ejemplo: el Na tiene 11 electrones en su estado elemental, el gas noble más cercano es el Ne que tiene 10. El Na tiende a perder un electrón al combinarse y de esta forma queda con carga +1. Ese es su estado o número de oxidación.
Si un elemento cede dos electrones su número de oxidación será +2 y si pierde tres electrones, será +3.
Otro ejemplo, el F tiene 9 electrones y busca adquirir la configuración electrónica del Ne que tiene 10 electrones y es el gas noble más cercano. Para ello el F tiende a ganar un electrón y queda con carga -1. Ese es su estado o número de oxidación.
Si un elemento gana dos electrones, su número de oxidación será -2 y si acepta tres electrones, será -3.
En los compuestos moleculares, como los átomos que intervienen son todos no metálicos (y por lo tanto no hay elementos que cedan electrones), la forma de adquirir la configuración electrónica del gas noble más cercano, será compartiendo electrones. El número de oxidación en este tipo de compuestos es la cantidad de electrones compartidos.
Algunos elementos tienen más de un número de oxidación, por ejemplo el Fe que tiene números de oxidación +2 y +3.
Para formular es fundamental recordar los números de oxidación de los elementos.