Compuestos oxigenados
Estos compuestos están constituidos por carbono, hidrógeno y oxígeno.
1. Alcoholes
NOMENCLATURA
Los alcoholes se pueden imaginar cómo derivados del agua en los que un hidrógeno ha sido reemplazado por un grupo alquilo. El grupo funcional se denomina hidroxilo.
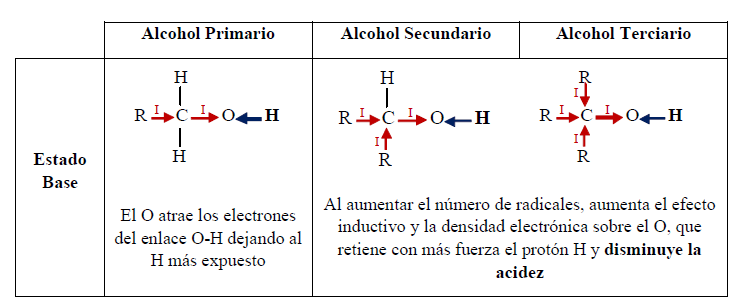
Se llaman alcoholes primarios los que presentan el grupo funcional
unido a un carbono primario. De manera análoga los alcoholes secundarios tienen
el grupo hidroxilo unido a un carbono secundario y los alcoholes terciarios son
los que lo tienen unidos a un carbono terciario.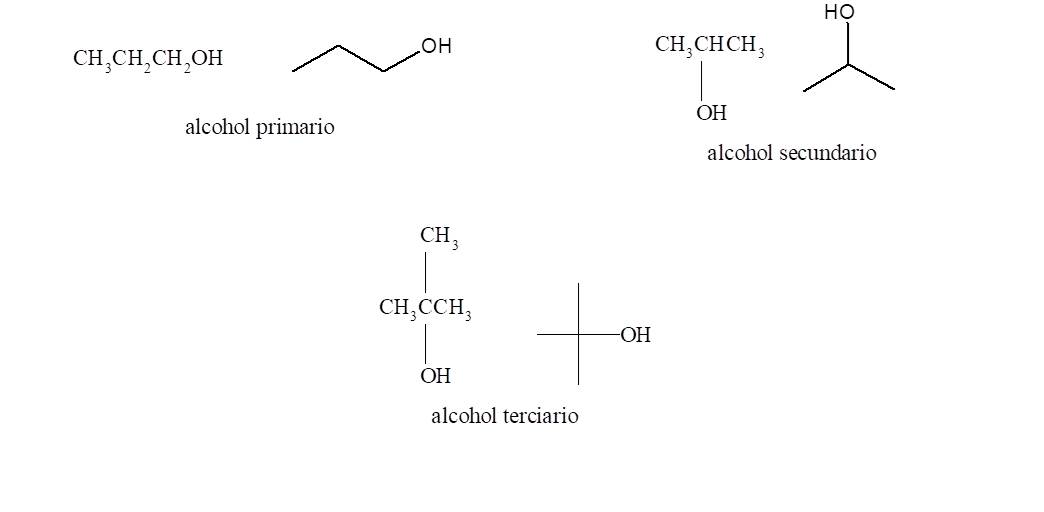
Para nombrarlos se siguen las siguientes reglas:
- Se determina la cadena de átomos de carbono más larga que contiene el grupo funcional y que dará origen al nombre base, cambiando la terminación ano por ol.
- Se numera esa cadena de forma de asignar al grupo funcional el menor número posible, independientemente de los grupos alquilo ramificantes.
- La posición a la que se une el grupo funcional
se indica con un número adelante del nombre y separado del mismo con un guión.
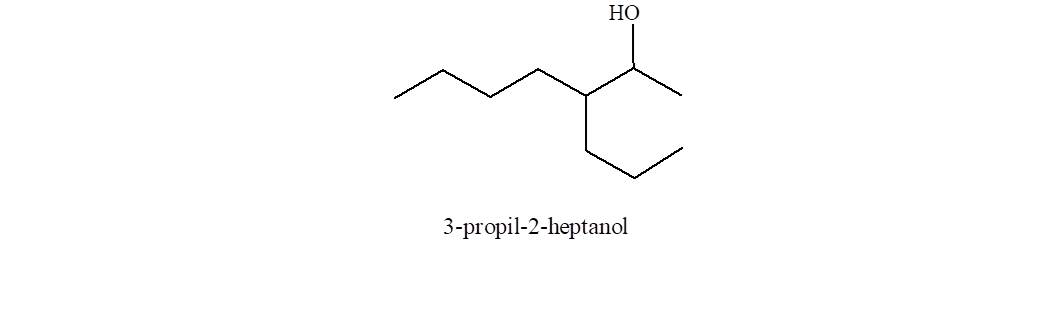
Observe que la cadena más larga es de ocho átomos de carbono, pero la cadena más larga que contiene el grupo funcional es de sólo siete.
Los alcoholes sencillos tienen un sistema de nomenclatura que no responden a las reglas IUPAC pero que está ampliamente difundido.
 PROPIEDADES FÍSICAS
PROPIEDADES FÍSICAS
Contienen el grupo −OH muy polar, lo que permite la formación de puentes de hidrógeno.
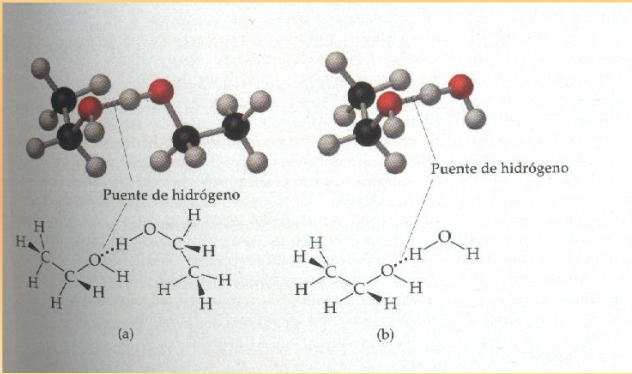
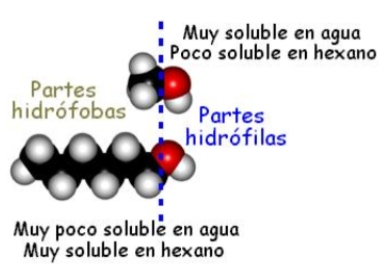
Solubilidad en agua
Disminuye al aumentar el tamaño del grupo alquílico
Los invitamos a visualizar el siguiente video del profesor Ernesto Brunet
PREPARACIÓN DE ALCOHOLES
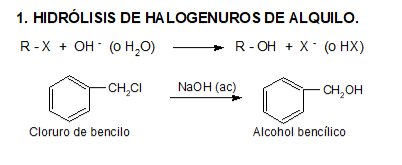
Otras formas de obtención de alcoholes son:
Adición de agua a alquenos
Adición de agua a alquinos
Oxidación de alquenos. Hidroxilación.
(Ver Unidad 3. Reacciones de Alquenos y Alquinos)
REACCIONES
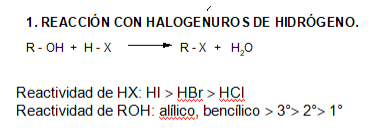
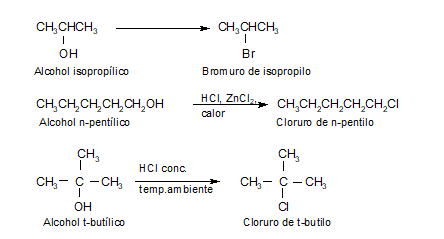
Este es uno de los métodos utilizados para preparar haluros de alquilo, los que también se obtienen a partir de alquenos por adición electrofílica.
El carácter de base de Lewis del alcohol permite la adición del H+ en una primer etapa, generándose un ión oxonio o alcohol protonado (R-OH2+), donde el enlace C-O es más polar que el del alcohol. Esto favorece la ruptura heterolítica de dicho enlace, con formación del ión carbonio.
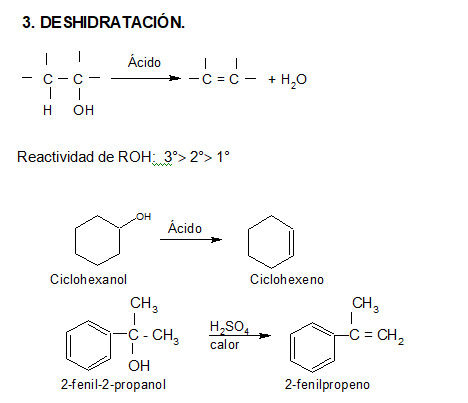
Los alcoholes, al ser calentados en medio ácido, se deshidratan intramolecularmente, formando alquenos. Para esto siguen un mecanismo de eliminación iónica.
ACIDEZ DE ALCOHOLES
Para comprender el tema Acidez y Basicidad les proponemos ver los videos del Profesor Ernesto Brunet.
Los alcoholes son sustancias que pueden actuar como ácidos o como bases.
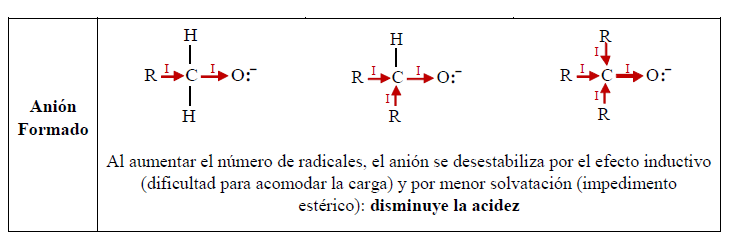
Como ácidos, los alcoholes presentan acidez similar al agua. El hidrógeno está unido al oxígeno (muy electronegativo), y la polaridad del enlace O-H facilita la separación de un protón, mientras que el oxígeno acomoda muy bien la carga negativa de los electrones dejados.
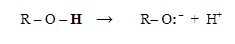
La diferencia entre el alcohol y el agua es el grupo alquilo:
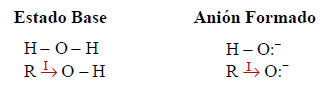
En el agua, al no haber grupo alquilo y por consiguiente efecto inductivo, el enlace O-H es más polar que en el alcohol. Además, el anión del agua es más estable que el del alcohol, en el cual el efecto inductivo aumenta la densidad negativa sobre el oxígeno, haciéndolo menos estable. Por otro lado, la solvatación del anión contribuye a la estabilización del mismo. A mayor tamaño del grupo alquilo, la solvatación se dificulta por el impedimento estérico, lo cual reduce la estabilidad del anión.
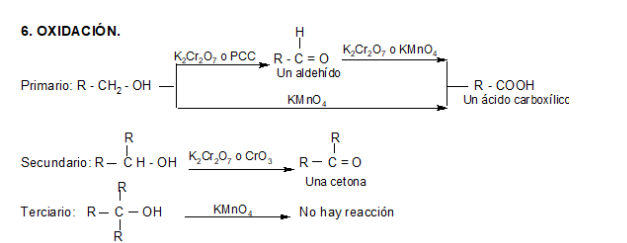
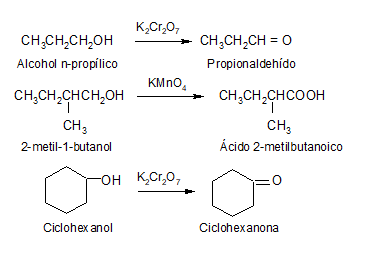
El compuesto que resulte de la oxidación de un alcohol depende del número de hidrógenos unidos al carbono enlazado con el grupo –OH, es decir, depende si se trata de un alcohol primario, secundario o terciario.
Alcoholes primarios
Un alcohol primario tiene dos hidrógenos unidos a carbono (R−CH2OH), de modo que puede perder hidrógeno para dar un aldehído o, incluso, un ácido. En ambos casos, conserva la cadena carbonada intacta.
Alcoholes secundarios
Un alcohol secundario puede perder su único hidrógeno (R2CHOH) para transformarse en una cetona, manteniendo inalterada la cadena carbonada.
Alcoholes terciarios
Un alcohol terciario (R3COH) no tiene hidrógenos unidos al carbono al que va unido el –OH, de manera que no es oxidado con métodos comunes, ya que debería romperse la cadena carbonada.